Лечение на пулмоналната артериална хипертония
Пулмоналната артериална хипертония (ПАХ) е заболяване, което се манифестира с дискретни симптоми и това води до забавяне на диагнозата. Поради ограничените възможности за лечение и тежката прогноза лечението на пациенти с ПАХ е предизвикателство за медицински специалисти от различни специалности. Нелекуваната пулмонална хипертония (ПХ) се характеризира с прогресивно увеличение на белодробното съдово съпротивление, десностранна сърдечна недостатъчност (ДСН) и смърт1. Според данни от 80-те години на XX век средната преживяемост на пациенти с идиопатична пулмонална артериална хипертония (ИПАХ) е 2.8 години от деня на поставяне на диагнозата. Смъртта на пациентите е тясно свързана с прогресивно влошаване на хемодинамиката1, 2, 3, 4, 5.
През последните години в рамките на рандомизирани и контролирани проучвания в лечението на ПАХ бяха регистрирани значителни успехи, касаещи преживяемостта и качеството на живот на пациентите1, 2, 3, 4, 5. Oт 2001 г. до момента в редица авторитетни медицински списания са публикувни насоки и консенсуси за лечение на ПАХ. На Третия световен симпозиум по пулмонална артериална хипертония във Венеция през 2004 г. клиничната номенклатура бе ревизирана и бяха направени препоръки за клиничната практика. Очаква се те да бъдат актуализирани на Четвъртия световен симпозиум през 2008 г.
Оценка на терапевтичните възможности
Пациенти с ПАХ, които не получават таргетно (насочено към повлияване на налягането в белодробната артерия) лечение, имат лошо качество на живот и висока смъртност, сравнима с тази при пациенти с налично злокачествено заболяване. През 1996 г. първото рандомизирано клинично проучване демонстрира ефективност от лечението с epostenol при тежка ИПАХ – III и IV функционален клас по NYHA. За последните десет години редица рандомизирани, плацебо контролирани проучвания, касаещи ефективността на простациклиновите аналози, ендотелин-рецепторните антагонисти (ЕРА) и фосфодиестеразните инхибитори, показаха сигнификантно подобряване на преживяемостта, прогнозата и функционалния клас. Така терапевтичните възможности при болни с ПАХ значимо се подобриха1, 2, 3,4, 5.
Терапевтични схеми с варираща степен на доказателственост подкрепят използването на нови класове медикаментозни средства. Някои широко използвани лечебни схеми при ПАХ са общоприети, бидейки важен и ефективен метод, макар че не се подкрепят от рандомизирани и контролирани клинични проучвания. Все още изборът на най-подходящо лечение е сложен и изисква осведоменост за развитието на заболяването, доказателства за терапевтичните ефекти на прилаганите медикаменти, за сложната система на медикаментозно преобразуване, за дозовите режими, страничните ефекти и усложненията в резултат на лечението.
Въведение към ниво на доказателственост и клас на препоръчителност
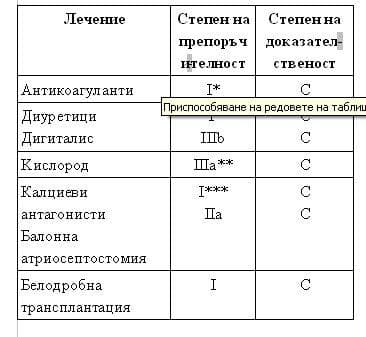
Системата за степенуване на нивото на доказателственост е основана предимно на броя благоприятни рандомизирани, контролирани клинични проучвания (РКП), проведени по отношение на дадена терапевтична стратегия (Табл. 1), и е адаптирана към специфичните изисквания на даденото рядко заболяване. Единствената разлика е, че в категория В не се включват нерандомизирани проучвания, тъй като всички проучвания при ПАХ са доста малки и следователно са включени в категория С. В категория В са включени „множество рандомизирани клинични проучвания с хетерогенни резултати”, защото такава ситуация може да възникне и тази дефиниция е по-разбираема дори когато крайният резултат е, че „едно рандомизирано клинично проучване” е с позитивен резултат. Анализът взема предвид малките проучвания и РКП при пациенти с ПАХ, публикувани в реномирани списания или представени на скорошни големи конгреси.
Таблица 1. Доказателственост и препоръчителност.

Съвременно лечение на ПАХ
До днес все още липсва дифинитивно лечение. Цел на провежданото лечение се явява значимото подобряване на очакваната преживяемост, физическото натоварване и качеството на живот. Конкретните схеми при всеки пациент с ПАХ са насочени към повлияване на основното заболяване, степента на тежест, очакваната прогноза, наличието и достъпа до съответните лечебни опции (например наличие на възможност за белодробна трансплантация) и икономически аспекти. Предпоставка за ефективно лечение е задълбоченото и компетентно информиране на пациентите и техните близки за естеството на заболяването и възможностите за неговото лечение. Важен момент е предоставяне на информационни материали, които биха помогнали за по-добра информираност на пациентите и техните близки, за създаване пациентски организации и др.
Общи мерки
Общите мерки са свързани с ограничаване на неблагоприятното въздействие на някои обстоятелства и външни субстанции при пациенти с ПАХ. Както и при други клинични състояния, влиянието на тези мерки не е доказано научно и препоръките са базирани на експертно мнение (клас IIa; ниво на доказателственост C).
Физическа активност
Не е установено дали физическата активност оказва негативно влияние върху еволюцията на ПАХ. Въпреки това потенциално опасни симптоми, като тежък задух, синкоп и гръдна болка, трябва да бъдат избягвани. Физическата активност трябва да се ограничи до свободно от симптоми ниво, за да се поддържа скелетната мускулатура в добро състояние. Физическата активност трябва да се избягва при екстремни температури. Подходящ режим на ежедневните занимания може да подобри качеството на живот и да намали честотата на поява на симптомите.
Сексуална активност
Честотата на функционалните сексуални нарушения при пациенти с ПАХ не са известни. Поради това липсва забрана на сексуална активност, която субективно се толерира добре от пациентите. С оглед превенция и предотвратяване на възможна сексуална дисфункция е добре пациентите да са информирани и запознати с подобна възможност.
Изкачване в планина
Хипоксията може да провокира вазоконстрикция
Пациенти с хронично белодробно сърце трябва да избягват пребиваването на големи височини (C, I). Бързото изкачване на височина от 2000 м може да доведе до значимо влошаване на дяснокамерната функция. Височини до 1200 м не би трябвало да водят до хемодинамични нарушения (C, I).
Пътуване със самолет
Представлява риск за всеки пациент с хронично белодробно заболяване и теоретично за всеки индивид с ПАХ. Налягането в кабината съответства на надморска височина между 2000 ± 2500 м. Съответната на това хипоксия и хипоксемия може да бъде компенсирана от допълнително подаване на кислород. Преди предприемане на всяко пътуване е необходимо да се осигури информация за най-близките клиники за лечение на ПАХ.
Хидротерапия или сауна
Липсват проучвания за наличието на риск. На пациентите обаче се препоръчва най-общо да спазват оптимален температурен режим, който по никакъв начин да не провокира задух и/или гръдна болка.
Подпомагащо лечение
Към подпомагащото лечение спадат мерки и прием на медикаменти, които са общовалидни за всички форми на ПАХ. Те се отнасят до общото състояние на пациентите и очакваната продължителност на живот. Тези мерки обаче никога не са били подлагани на изследване в рамките на контролирани проучвания (Табл. 2).
Таблица 2. Препоръчителни медикаменти при ПАХ.
* Валидно за ИПАХ и АПАХ при колагенози;
** Препоръчва се съобразно изискванията за дълготрайна кислородотерапия;
*** Само при пациенти с ИПАХ, изпълнили критериите за позитивен вазодилататорен отговор.
Хемодилуция
Индикация се явява спешната необходимост от подобряване на реологията на кръвта, а относителна контраиндикация са загуба на кислороден транспортен капацитет, понижаване на собствения резерв от желязо и негативен ефект на микроцитозата за реологията. При синдром на Eisenmenger се препоръчва корекция на полиглобулията едва тогава, когато се появят клинични симптоми (най-често неврологични) за хипервискозитет (главоболие, зрителни нарушения, транзиторни исхемични атаки) (C, IIa). Профилактична хемодилуция се налага при хематокрит, надвишаващ 65±70%, респективно хемоглобин – 205 g/l (Клас IIа; ниво на доказателственост С).
Антикоагуланти
Логиката за използване на перорална антикоагулантна терапия произлиза от наличието на традиционни рискови фактори за венозна тромбоемболия, като сърдечна недостатъчност и заседнал начин на живот, както и от доказателства за тромбофилна предиспозиция, за тромботични промени в белодробната микроциркулация и еластичните белодробни артерии. Доказателствата за благоприятни ефекти на пероралната антикоагулантна терапия при пациенти с ИПАХ или ПАХ, свързана с анорексогени, са на базата на ретроспективен анализ на едноцентрови проучвания. За пациенти с ИПАХ и фамилна ПАХ (ФПАХ) е налице индикация за антикоагулация с цел постигане стойности на INR – 1.5-2,5; за пациенти с протромботични рискови фактори INR трябва да е 2.0-3.5 (C, I). Същите правила важат и за ПАХ, свързана с болести на колагена (АПАХ), HIV-инфекция и прием на апетитопотискащи медикаменти, както и при ПАХ при венооклузивни заболявания и десностранна сърдечна недостатъчност. При портопулмонална хипертония и при синдром на Eisenmenger препоръките са по-скоро за въздържане от антикоагулация (C, IIb). За групата белодробни заболявания, при които е налице белодробна хипоксия, само при изключителни случаи се налага антикоагулация (C, III). За разлика от това при пациенти с хронична тромбоемболична пулмонална хипертония препоръките за лечение са ясни: назначават се до края на живота, освен ако са налице противопоказания; цел на антикоагулантното лечение е постигане на INR – 2.5-3.5 (C, I). За прогностичните ефекти от приложението на тромбоцитни антиагреганти (например acetysal или clopidogrel) липсват достатъчно доказателства.
Доказателствата, подкрепящи антикоагулацията при пациенти с ИПАХ, могат да бъдат екстраполирани за други пациенти с ПАХ, при условие че съотношението риск/полза е внимателно преценено. Преобладава мнението, че рискът от гастроинтестинално кървене е по-висок при пациенти с ПАХ, свързана с болести на съединителната тъкан. Пациенти с ПАХ, свързана с вродени сърдечни дефекти с интракардиален шънт, имат повишен риск от хемоптиза, но също така и повишен риск от парадоксални емболии в белодробната артерия и мозъчна венозна тромбоза. Пациенти с порто-пулмонална хипертония имат повишен риск от кървене от гастроинтестиналния тракт в резултат от наличие на варици и ниски нива на тромбоцити. Пациенти на хронична венозна терапия с epoprostenol се антикоагулират при липсата на контраиндикации и това се дължи на допълнителен риск от катетер-свързана тромбоза. В скорошните рандомизирани проучвания 51-86% от пациентите приемат перорални антикоагуланти. Интересен е фактът, че най-високо ниво на лечение с перорални антикоагуланти се наблюдава при пациенти с ИПАХ от III и IV функционален клас по NYHA, докато най-ниска честота на прием се отбелязва при индивиди със склеродермия. Липсват доказателства за разлика в ефикасността на пероралната антикоагуланта терапия в зависимост от функционалния клас или други показатели за тежестта на заболяването (клас IIа; ниво на доказателственост С за ИПАХ; клас IIb; ниво на доказателственост С за други ПАХ състояния).
Диуретици
Пациенти с декомпенсирана десностранна сърдечна недостатъчност имат задръжка на течности, която води до повишено централно венозно налягане (ЦВН), абдоминална органна конгестия, периферни отоци и в напреднали случаи – до асцит. Подходящата диуретична терапия води до ясно изразено симптоматично и клинично подобрение дори при липсата на специфични рандомизирани клинични проучвания. В скорошни такива 49-70% от пациентите приемат диуретици. Въпреки това липсата на проучвания със специфични класове от диуретици и индивидуалната вариабилност в отговора оставят избора за типа и дозата на медикамента при индивидуалния пациент на опита на лекаря. Серумните електролити и показателите за бъбречната функция трябва да се проследяват при пациенти на диуретична терапия1, 2, 3, 4, 5. Много пациенти с ПХ имат нужда от диуретично лечение (C, I). Дългодействащите калий-съхраняващи медикаменти (антагонисти на алдостерона) са за предпочитане пред бримковите диуретици (C, I). При десностранна сърдечна недостатъчност и повишено централно венозно налягане е необходимо обаче често приложение на бримкови диуретици (Клас I; ниво на доказателственост С).
Дигиталисови препарати
За приложението им няма изградено единно становище. Логиката в приложението на инотропните медикаменти идва от факта, че потискането на миокардния контрактилитет е едно от основните събития в прогресията на дясностранната сърдечна недостатъчност. При пациенти с тахикардия и предсърдно мъждене/трептене те се явяват медикамент на първи избор (C, I). Digoxin е използван при 18-53% от пациентите с ПАХ, включени в рандомизирани клинични проучвания. В повечето експертни центрове пациенти в краен стадий на ПАХ са на венозно лечение с dobutamine. То често дава клинично подобрение, траещо различно дълго време, подобно на пациентите с напреднала лявостранна сърдечна недостатъчност (Клас IIb; ниво на доказателственост С).
Кислород
При повечето от пациентите с ПАХ (с изключение на тези с вродени сърдечни пороци) се установява лекостепенна хипоксемия в покой. Засега липсва еднозначна информация по отношение на дългосрочната терапия с кислород. Необходимо е поддържане на постоянна кислородна сатурация над 90%. Индикациите за приложение на дълготрайно домашно кислородно лечение се основават на общоприетите препоръки и формулирани критерии. Ако се установи наличие на нощни десатурации под 85%, са налице индикации за кислородна терапия по време на сън (C, IIa). По-противоречиво е използването на кислород при пациенти с ПАХ, свързана със сърдечен шънт. При контролирано проучване на болни със синдром на Eisenmenger нощната кислородна терапия не показва позитивен ефект върху хематологичните параметри, качеството на живот или преживяемостта. Ефектът от продължителното приложение на кислород в тези случаи не е известен, поради което при синдром на Eisenmenger не се дават общи препоръки за приложение на кислород (B, IIb) (клас IIа; ниво на доказателственост С).
Лечение с антибиотици/имунизации
Пациенти с ПАХ имат склонност към развитие на пневмонии, които са причина за смърт в 7% от случаите. Белодробните инфекции не се понасят добре и трябва да бъдат диагностицирани и лекувани възможно най-бързо. Наличието на персистиращ фебрилитет при пациенти с венозен катетер за продължително приложение на epoprostenol поражда съмнение за катетерна инфекция. Своевременното приложение на антибактериално лечение при наличие на бактериална инфекция е строго препоръчително и има за цел да предотврати декомпенсацията на дясностранната сърдечна недостатъчност (C, I). Препоръчва се ежегодна профилактична имунизация срещу грипни вируси и пневмококи (C, I) (клас I; ниво на доказателственост С).
Контрацепция
Бременността и раждането при пациентки с ПАХ са свързани с повишена честота на клинично влошаване и смърт. На жени в детеродна възраст се предписва надеждна контрацепция, тъй като бременност и износване на плод са свързани с висок риск от дясностранна сърдечна декомпенсация (C, I). Рискът от прием на орални контрацептивни медикаменти при пациентки във фертилна възраст, които приемат орални антикоагуланти, не се разглежда като фактор от особено значение. Някои експерти предлагат използване на продукти без естроген, оперативна стерилизация или бариерни методи на контрацепция. Няма яснота по въпроса за хормоналната терапия при постменопаузални пациентки с ПАХ. По всяка вероятност тя е оправдана само при наличие на непоносими менопаузални симптоми и е в съчетание с антикоагулация. При лечение с ендотелин-рецепторни антагонисти (поради възможна кръстосана реакция между тях и контрацептивни медикаменти) се препоръчва да се въведе допълнителен или алтернативен метод за предпазване (клас I; ниво на доказателственост С).
Психологична подкрепа
Пациентите с ПАХ имат средна продължителност на живота 40 години и ограничен физически капацитет, който може значително да промени предишния им начин на живот. Освен това информацията за тежестта на заболяването е достъпна чрез различни непрофесионални източници, които могат да бъдат несъвременни, объркващи или недостатъчно ясни. По тази причина много пациенти страдат в различна степен от безпокойство и/или депресия, което може да окаже значително влияние върху начина им на живот. Ролята на експертите в областта на ПАХ е важна за осигуряване на подходяща информация (включително съобщаване на лоши новини) и при необходимост за насочване към психолог или психиатър. Полезни са също и помощни групи за пациенти и техните семейства със или без участие на психолог или психиатър, тъй като те подобряват разбирането и приемането на болестта.
Планова хирургична намеса
Плановата хирургия носи повишен риск, който нараства с повишение на функционалния клас по NYHA и в случаите на гръдни или коремни интервенции. Няма препоръки, касаещи най-подходящата анестезия, толерирана от пациентите, но по всяка вероятност епидуралната се понася по-добре от общата. Последната трябва да се прилага само от опитен анестезиолог в присъствие на експерт по ПАХ с цел избиране на най-подходящо лечение в случай на усложнение. Пациенти на лечение с венозен epoprostenol и субкутанен treptostinil би трябвало да имат по-малко усложнения в сравнение с пациенти на перорални или инхалаторни режими. Последните са подложени на временни затруднения в лекарственото приложение в резултат на гладуване, обща анестезия или асистирана вентилация. В случаите, когато се предвижда дълъг период на невъзможност за приемане на медикамента (повече от 12-24 часа), се препоръчва преминаване към венозно приложение за времето на интервенцията. Спирането на антикоагулантната терапия е за възможно най-кратък период от време и при провеждане на профилактика за дълбоки венозни тромбози.
Медикаменти, неефективни при лечение на ПАХ
Трябва да се избягва приложение на β-блокери, доколкото в основата на ПХ не лежи лявостранна сърдечна недостатъчност. Калциевите антагонисти не са средство на избор при не-респондери или при пациенти, които не са отговорили позитивно по време на острия вазодилатативен тест. За АСЕ-инхибитори, антагонисти на ангиотензина и нитрати, респективно molsidomin, липсват данни за позитивен ефект в дълготраен порядък. Пациенти с ПАХ и системна хипертония се повлияват позитивно най-често непосредствено след спиране на лечението с тези медикаменти (клас C, ниво на доказателственост III).
Съпътстващи медикаменти
Необходимо е да се избягват лекарства, които взаимодействат с пероралните антикоагуланти или увеличават риска от гастроинтестинално кървене. Въпреки че нестероидните противовъзпалителни средства не са свързани с ПАХ, от проведени досега проучвания употребата им може допълнително да редуцира гломерулната филтрация при пациенти с нисък сърдечен дебит и преренална азотемия. Свързаните с ПАХ анорексогени са извадени от употреба. Ефектите на новата генерация серотонин-свързани анорексогени не са известни, но досега няма съобщения за белодробно-свързани странични ефекти.
Медикаменти, насочени към лечението на ПАХ
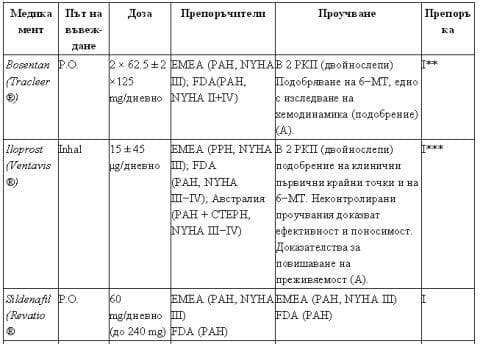
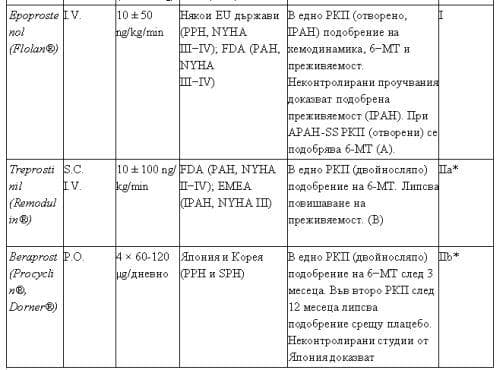
На Табл. 3 са представени данни, базирани на доказателства, за медикаменти, чието приложение е било изпитано в рамките на рандомизирани и контролирани проучвания.
Таблица 3. Медикаменти, приложени за лечение на ПАХ, изпитани в РКП.
EMEA: European Medicinal Agencies – Европейска агенция за лекарствата.
FDA: Food&Drug Administration – Американска агенция за храни и лекарства.
PPH: първична ПХ, ИПХ, фамилна ПХ.
SPH: вторична ПХ; понятие, което сега не се използва, включващо всички форми на ПХ с позната етиология или познато основно заболявне.
РКП: рандомизирано контролирано проучване.
6-MW: 6-минутен тест с ходене.
PAH-SS: склеросермия, асоциирана с ПАХ.
** За NYHA IV – степен на доказателственост B, степен на препоръчителност IIa.
*** За APAH и CTEPH е валидна степен на доказателственост B, степен на препоръчителност IIa.
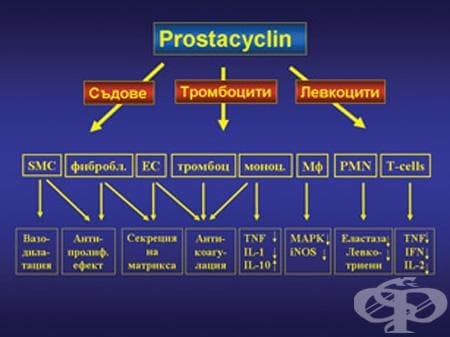
След въвеждането на простациклините, ендотелин-рецепторните антагонисти, фосфодиестеразните инхибитори и азотния окис (NO) в клиничната практика терапевтичните възможности, както и прогнозата на ПАХ значимо се подобриха. За основна причина, водеща до ПАХ днес се счита дисфункцията на ендотела, която се характеризира с понижена продукция на вазодилататорни субстанции, като NO или простоциклин, и повишена продукция на вазоконстрикторни субстанции като ендотелин и тромбоксан. Разбирането на тези механизми даде възможност за промяна на насоките в терапевтичния подход и промяна в целите на лечението, а именно ремоделиране на белодробното съдово легло.
Високи дози калциеви антагонисти
Могат да доведат до много добро повлияване на хемодинамиката и натоварването в дългосрочен порядък при пациенти с ИПАХ и ФПАХ, които показват мощна белодробна вазореактивност (C, I). Кандидати за това лечение обаче са само тези, които са изпълнили критериите за позитивен отговор при фармакологичен тест (т.нар. респондери). Само около 10-15% от пациентите с ИПАХ изпълняват критерия за позитивен остър съдово-реактивен отговор и само около половината от тях ще отговорят благоприятно клинично и хемодинамично на дългосрочно лечение с калциеви антагонисти. Благоприятни резултати от дългосрочно лечение с високи дози е доказано и при деца с ИПАХ. Дозата се определя според ефективността и поносимостта и се титрира индивидуално. Желателно е при реактивни пациенти да се започне с по-ниски дози (т.е. с 30 mg ретарден nifedipin два пъти дневно или 60 mg diltiazem три пъти дневно) и да бъдат покачвани постепенно и внимателно през следващите седмици до максимално поносима доза. Лимитиращи фактори обикновенно са системна хипотония и периферни отоци по долни крайници. В някои случаи добавянето на digoxin и/или диуретици може да намали страничните ефекти от калциевите антагонисти. В съображение влизат най-често nifedipin (120 ± 240 mg/дневно), diltiazem (360 ± 900 mg/дневно) или amlodipin (15 ± 30 mg/дневно). При приложението им най-често се постига ПАХ между 20 и 40 mm Hg и клас I-II по NYHA. Не се препоръчва предписване на калциеви антагонисти без извършване на вазореактивен тест (C, III) (Клас I, ниво на доказателственост С за ИПАХ; клас IIb, ниво на доказателственост С за друга ПАХ).
Простаноиди. Интравенозен простациклин
Простациклинът е открит 1976 г. Той е вазодилататорен простагландин, който се синтезира и освобождава от съдовия ендотел и е най-мощният ендогенен инхибитор на тромбоцитната агрегация. Изглежда, че притежава още цитопротективен и антипролиферативен ефекти, медиирани чрез вътреклетъчния цикличен аденозин-монофосфат (цАМФ). През 1996 г. са първите публикувани резултати за венозно приложение на epoprostenol при пациенти с ИПАХ, като той е първото лекарство, одобрено от FDA за дълготрайна венозна инфузия при пациенти с функционален клас III и IV по NYHA.
Първоначално клиничната употреба на epoprostenol е била основана на белодробните му вазодилататорни ефекти, доказани в краткотрайни проучвания, и този негов остър ефект се използва понастоящем за тестване на съдовата реактивност на белодробната циркулация. От друга страна, дори пациенти, които не проявяват остър съдово-реактивен отговор на epoprostenol, показват клинично и хемодинамично подобрение при дългосрочно лечение. На практика дългосрочното венозно приложение на epoprostenol понижава периферното съдово съпротивление (ПСС) в по-голяма степен, отколкото го понижават острите съдово-реактивни тестове. Хипотезата, с която могат да се обяснят тези резултати, се основава на инхибиторния ефект на простациклина върху съдовия растеж, ремоделирането и облитерацията, който улеснява частичното възстановяване на променените функции на белодробната микроциркулация. Точният механизъм на действие обаче е неизвестен и най-вероятно е многофакторен.
Интравенозният простациклин (epoprostenol, Flolan®) се използва в много страни като стандартна терапия при пациенти с тежка ПХ (A, I). Едно тримесечно отворено контролирано проучване показва сигнификантнa ефективност върху хемодинамиката, натоварването и преживяемостта в полза на лекувани пациенти1, 6. Друго проучване при пациенти, асоциирани със склеродермия, показва позитивен ефект върху натоварването. Най-чести странични действия при венозното приложение на epoprostenol са главоболие, болки в долната челюст и долни крайници, гадене, разстройство и асцит. Тежко усложнение могат да са септични и тромботични прояви при наличие на централен венозен катетър, както и преустановяване на лечението поради дислокация на катетъра или проблеми в помпата. Дозата при приложение повече от две години варира между 40 и 60 ng/kg/min. Терапията с еpoprostenol се счита за средство на първи избор при пациенти с ПАХ в IV функционален клас по NYHA и е последна форма на терапия, когато всички други са провалени.
Интравенозен iloprost
Той е стабилен простациклинов аналог, алтернатива на приложението на интравенозен epoprostenol, като в някои страни се предпочита, въпреки ниския клас на доказателственостl (C, IIa). Поради своята химична стабилност този медикамент има по-големи практически предимства, сравнен с epoprostenol. Препоръчваната дозировка обичайно е между 1 и 5 ng/kg/min, в единични случаи – до 10 ng/kg/min.
Инхалаторен iloprost
Въведен е в клиничната практика през 90-те години на XX век. Инхалаторната терапия при ПАХ представлява привлекателна алтернатива, която има теоретичното предимство, че е селективна за белодробната циркулация. Тъй като интраацинарните белодробни артерии са в съседство на алвеоларните единици, възможно е тези съдове да се разширяват от алвеоларно депозиране на вазодилататори. От особена важност е аерозолираните частички да бъдат достатъчно малки (диаметър 3-5µm), за да могат да проникнат в алвеолите. След единична инхалаторна доза на iloprost се наблюдава редукция на средното пулмоартериално налягане (СПАН) с 10-20%, което трае 45-60 минути. Кратката продължителност на ефекта изисква чести инхалации (от 6 до 12 пъти дневно), за да се постигне продължителен ефект при дългосрочно приложение. С небулизатори тип Jet продължителността на всяка инхалация е около 15 минути; използването на алтернативни устройства, като ултразвукови небулизатори, намалява инхалаторното време до около 5 минути.
Инхалаторният iloprost показва добра поносимост. Рядко се наблюдава кашлица, зачервяване на лицето и главоболие. Проведено е дългосрочно неконтролирано проучване при 25 пациенти с ИПАХ, лекувани поне една година с инхалаторен iloprost – 100- 150µg/дневно; резултатите показват увеличение на изминатото разстояние при 6-минутния тест с ходене (6-МТ) със средно 85 метра, намаление на СПАН със 7 mm Hg и увеличение на сърдечния индекс с 0.6 L/min/m2. В малко проучване върху осем пациенти с ПАХ и белодробна фиброза е установено, че острото приложение на инхалаторен iloprost довежда до изразена белодробна вазодилатация, при съхранена газова обмяна и системно артериално налягане.
Лечението с инхалаторен iloprost е одобрено от EMEA в Европа за пациенти с ИПАХ в III функционален клас по NYHA и в Австралия и Нова Зенландия – за пациенти с ПАХ и неоперативна хронична тромбоемболична пулмонална хипертония (ХТПХ) в III и IV функционален клас по NYHA. Едно проспективно рандомизирано, двойно сляпо, мултицентрово европейско проучване (Aerosolized Iloprost Randomized, AIR) при пациенти с ПАХ и ХТПХ с III-IV функционален клас по NYHA потвърждава клиничната ефективност и добрата поносимост на препарата. Приложението на медикамента става със специално препоръчани системи за небулизация. Дозировката е между 6 пъти по 2.5 µg и 9 пъти по 5 µg/дневно.
Beraprost
Този стабилен простациклинов аналог за орално приложение е разрешен за употреба в Япония и Корея при пациенти с първична и вторична ПАХ. Приложението му не е базирано на резултати от клинични изпитвания, за разлика от препоръките в другите страни. В Европа е осъществено едно двойносляпо рандомизирано приучване, включващо 130 пациенти с ИПАХ и форми на вторична ПАХ, които показват маргинално (със статистическа достоверност) подобрение на резултатите при 6-минутния тест с ходене. В рамките на друго проучване не е установена разлика след 12-месечно лечение с beraprost, сравнен с плацебо1, 2, 3, 4, 5. Сравнително често при лечение с beraprost са налице странични явления от страна на гастроинтестиналния тракт, главоболие, болки по костите. До сега beraprost не се използва нито в Европа, нито в Америка.
Treprostinil
Подкожно или интравенозно приложимият простаноид treprostinil е изследван в едно голямо двойносляпо, мултицентрово проучване; резултатите показват, че за 12-седмично наблюдение с 6-минутен тест се регистрира ограничено, но сигнификантно повишаване на изминатата дистанция с 16 метра. Нито в тази фаза на наблюдение, нито при дълготрайното наблюдение за период над една година е установено, че се променя преживяемостта на лекуваните пациенти, сравнени с плацебо. Междугрупов анализ показва сигнификантно по-добри терапевтични резултати при ПАХ, асоциирана с колагенози. В Америка и Франция препаратът е индициран за лечение на пациенти с ПАХ с II-IV функционален клас по NYHA. Практическото приложение се ограничава от честите и тежко изразените локални странични ефекти. FDA и EMEA са разрешили приложението на treprostinil и под форма на трайна венозна апликация в случаите, при които подкожната апликация води до непоносими странични явления.
Двойно селективни ендотелин-рецепторни антагонисти. Bosentan е блокер на рецепторите за ендотелин А (ETА) и ендотелин B (ETB). Показва сигнификантни терапевтични ефекти в рамките на две рандомизирани, двойно слепи проучвания при пациенти с ИПАХ и ПАХ, асоциирана със склеродермия, с III и IV функционален клас по NYHA. От 2002 г. bosentan е разрешен за употреба в Европа (за ПАХ с III функционален клас по NYHA) и в Америка – за лечение на ПАХ с IV функционален клас по NYHA. Специален проблем при лечението е хепатотоксичността, предизвикана от реверзибилното потискане на транспорта на жлъчни соли (около 10% от всички случаи) и налагаща преустановяване на лечението (при 3 ± 5%). При пациенти, подложени на лечение, се налага ежемесечно проследяване на аминотрансферазите за преценка на дозата и за своевременна реакция при наличие на странични ефекти. Bosentan не трябва да се назначава при пациенти с налична тежка увреда на чернодробната функция (клас B и C по Child-Pugh). Води до индукция на лекарства-метаболизиращите ензими, което засяга както phenprocoumon (Marcumar), така и други антагонисти на витамин K, контрацептиви и sildenafil. Други странични ефекти са образуване на отоци (при 10% от пациентите) и тератогенни свойства на субстанцията. Медикаментът не трябва да се приема засдно с cyclosporin A и glibenclamid. В рандомизирано, контролирано проучване се докладва за сигнификантен успех в лечението при пациенти със синдром на Eisenmenger. Данни от проучвания при малки групи пациенти показват позитивни резултати при ПХ, асоциирана с HIV, при порто-пулмонална хипертония и чернодробна цироза стадий А по Child. Публикувани серии от случаи на пациенти свидетелствуват за това, че комбинираното лечение с bosentan, sildenafil и инхалаторен или орален простаноид със сигурност е ефективно (C, IIa).
ETA-селективни ендотелин-рецепторни антагонисти
Представители на тази група (sitaxsentan, ambrisentan) в момента са подложени на клинично изпитване за преценка на терапевтичната им ефективност. Лечението на ПАХ с ендотелин-рецепторни антагонисти е предмет на дискусия в друга статия на този брой на списанието, където те ще бъдат коментирани подробно.
Инхибитори на фосфодиестераза-5 (PDE5i)
Sildenafil е перорален активен, мощен и селективен инхибитор на фосфодиестераза тип 5 (ФДЕ-5), който упражнява фармакологичния си ефект чрез увеличение на интрацелуларната концентрация на цикличен гуанозин-монофосфат (cGMP). Увеличението на този нуклеотид довежда до релаксация и антипролиферативен ефект върху съдовите гладкомускулни клетки. Едно малко рандомизирано, контролирано, двойно-сляпо проучване от Индия показва сигнификантна ефективност на sildenafil върху физическия капацитет и качеството на живот при пациенти с ИПХ. В друго рандомизирано контролирано проучване с cross-over дизайн sildenafil е приложен три пъти дневно по 25-100 mg при 22 пациенти с ПАХ и с II и III функционален клас по NYHA; след шест седмици се отчита подобряване на симптомите, на хемодинамиката и на физическия капацитет, оценен по протокола на Naughton на бягаща пътека (време на натоварване от 475 ± 168 sec в края на плацебо фазата; до 686 ± 224 sec в края на фазата със sildenafil). Едно световно голямо, двойно сляпо проучване при пациенти с подбрани форми на ПАХ (SUPER-1) показва също така сигнификантна ефективност. В Европа sildenafil е разрешен и индициран за употреба при ПАХ с III функционален клас по NYHA, а в Америка и Канада това е валидно за Revatio®. Проучвания доказват добра ефективност при комбинирането им с простаноиди и bosentan. Терапевтичната ефективност на PDE5i включва също и ПАХ при интерстициални белодробни заболявания, както и неоперабилни пациенти с ХТПХ.
Препоръчителната доза на sildenafil при ПАХ е 3 пъти по 20 mg дневно. До момента липсват достатъчно проучвания, касаещи ефективността на тази терапевтична дозировка. Много от пациентите получават по-висока дневна доза. Не са изучени и ефектите на понижаване на дозата. Последното може да ограничи белодробната хемодинамика и да създаде животозастрашаваща ситуация.
Друг един представител на PDE5i - tadalafil се намира в период на клинично изпитване.
Комбинирано лечение
Комбинираната терапия представлява атрактивен вариант за противодействие на всички патофизиологични механизми, които са налице при ПАХ. Може да се прилага, като се започне лечение едновременно с два (или повече) медикамента или като се добави втори (или трети) медикамент към предишната терапия, която е отчетена като недостатъчно ефективна. Към момента не е известно коя от тези две стратегии е по-добрият избор. Ефикасността и безопасността от едновременното прилагане на bosentan и еpoprostenol е проучена при 33 пациенти с ПАХ с III и IV функционален клас по NYHA (BREATHE-2).
В много случаи едва комбинираното лечение с медикаменти от различни групи води до задоволителни клинични резултати. Може да се очаква, че комбинираното лечение, имащо за цел непрекъснато подобряване на ПАХ, ще се окаже бъдещ стандарт и за целта са стартирани контролирани проучвания. Комбинираното лечение, като първа стъпка в терапевтичната схема, се препоръчва и при декомпенсирана дясностранна сърдечна недостатъчност или при заплашваща мултиорганна недостатъчност (степен на доказатественост C, степен на препоръчителност IIa).
Други терапевтични подходи
Атриална септостомия
Наличие на вродени шънтове между големия и малкия кръг на кръвообръщението повлияват преживяемостта при пациенти с ПАХ. Вторичнo призвикани предсърдни септални дефекти (атриална септостомия) може да подобрят прогнозата и симптомите при пациентите с ПАХ (степен на доказателственост C, степен на препоръчителност IIa). Няколко експериментални и клинични проучвания предполагат полза от междупредсърден дефект в условие на тежка ПАХ. Наличието на междупредсърден дефект, опосредстващ дясно-ляв шънт, би довело до увеличение в системния кръвоток, което (въпреки спада в системната артериална кислородна сатурация) води до увеличение на системния кислороден транспорт. Освен това шънтът на междупредсърдно ниво би намалил симптомите и признаците на дясностранна сърдечна недостатъчност.
Ролята на атриалната балонна септостомия за лечение на пациенти с ПАХ е неизяснена, тъй като нейната ефикасност е демонстрирана само в малки серии и отделни клинични описания (приблизително 120 публикувани случаи). Процедурата се извършва с помощта на катетърна техника, при което транссептално се поставя балонен катетър и се дилатира в предсърдния септум, докато системната артериална сатурация не спадне значимо – максимално с 10%. Посредством атриалната септостомия се повишава транспортът на кислород (въпреки спадането на артериалната сатурация на O2) и в дългосрочен план се подобрява дяснокамерната функция. Въпреки това обаче трябва да се отбележи, че интервенцията носи рискове, особено в случаи, при които е налице манифестна дяснокамерна декомпенсация и пониженa кислородна сатурация в артериалната кръв. В повечето случаи тази процедура е прилагана при тежко болни пациенти като палиативен мост към белодробна трансплантация, което би могло да обясни процедурната смъртност (от 5 до 15%). Освен подобрение в симптоматиката и хемодинамиката демонстрирана е и повишена преживяемост в сравнение с исторически контролни групи.
Днес атриалната балонна септостомия е индицирана при пациенти с напреднала сърдечна недостатъчност – III и IV функционален клас по NYHA, със скорошен синкоп и/или десностранна сърдечна недостатъчност, въпреки цялата достъпна медикаментозна терапия. Септостомията се използва или като палиативен мост към белодробна трансплантация, или като единствена процедура, когато не са достъпни други възможности. Атриалната балонна септостомия трябва да се осъществява само в центрове с достатъчен опит с цел да се избегнат процедурни рискове.
Белодробна трансплантация
Има важно значение при пациенти, които не отговарят задоволително на медикаментозното лечение (степен на доказатественост C, степен на препоръчителност I). Трансплантацията на бял дроб и сърце-бял дроб при ПАХ е оценена само в проспективни неконтролирани проучвания (формалните рандомизирани контролирани проучвания се считат за неетични) при липса на алтернативни терапевтични възможности. Смъртността при трансплантация при ИПАХ достига до 25% в първите седмици след интервенцията и 35±40% след една година.
Провеждани са както едностранна, така и двустранна белодробна трансплантация и тези операции са комбинирани с корекция на сърдечни пороци за синдрома на Eisenmenger. Преживяемостта на реципиентите е подобна за едностранна и двустранна трансплантация. При наличие на технически възможности всяка от тези операции е средство на избор за повечето случаи на ПАХ. В настоящия момент повечето трансплантационни центрове предпочитат осъществяване на двустранни белодробни трансплантации поради по-малкото следоперативни усложнения. Резултатите, касаещи преживяемостта след белодробна трансплантация за период от четири години, не са се променили в международен мащаб. Трансплантацията на бял дроб и сърце-бял дроб е индицирана при пациенти с напреднала ПАХ – III и IV функционален клас по NYHA и симптоми, рефрактерни на достъпното медикаментозно лечение.
Терапевтичен алгоритъм
След основно диагностично изследване, целящо изясняване на причините, определяне на степента на тежест и след острия тест за реверзибилност на пациентите се назначава конвенционална подпомагаща терапия и таргетна терапия, насочена към понижаване на налягането в белодробната артерия. Тази терапия трябва да съответства на законовата база за разрешени медикаменти, индивидуалните особености при отделните пациенти, терапевтичните рискове, страничните действия, ефективността и времето за настъпване на ефектите, наличността на клиничен опит и цената1, 3, 5. На Фиг. 3 е представен терапевтичният алгоритъм за лечение на ПАХ.
Препоръчва се преди започване на подобно лечение пациентите да се консултират в специализирани центрове. Данните за терапевтичната ефективност при различните форми на ПАХ са противоречиви, като такава липсва при много подгрупи. При лявостранни сърдечни заболявания, протичащи с ПХ, таргетните медикаменти носят дори риск за влошаване на състоянието. Това е валидно и за форми на ПАХ със сигнификантно венозно или капилярно участие. При ХТПХ средство на избор е ендартеректомията – успешен хирургичен метод, който, наред с рисковете, може да доведе до забележителни резултати. Медикаментозното лечение има ограничено приложение в тези случаи и все още е в началото на своето развитие.
Бъдещите клинични въпроси ще бъдат концентрирани вероятно върху прогнозата на лекуваните пациенти, и то за онези клинични форми, които не са били подложени на клинично изпитване. Друг въпрос, който очаква отговор, е каква е ефективността на комбинираното лечение с участие на комбинация от медикаменти с различен механизъм на действие. При разрешаването на тези въпроси не на последно място се поставя икономическият фактор, имайки предвид високата цена на всички тези медикаменти. Към отворените въпроси се отнася и стандартизирането на ранни методи за диагноза, което би могло да повлияе хода и протичането му.
Диана Петкова, д-р, дм, гл. асистент, Клиника по пневмология и фтизиатрия, УМБАЛ “Св. Марина” - Варна, МУ “Проф.д-р Параскев Стоянов” – Варна
Литература
1. Galie N, Torbicki A, Barst R, et al. Guidelines on diagnosis and treatment of pulmonary arterial hypertension. The Task Force on Diagnosis and Treatment of Pulmonary Arterial Hypertension of the European Society of Cardiology. Eur Heart J 2004; 25 (24): 2243-227
2. Badesch DB, Abman SH, Ahearn GS, et al. Medical therapy for pulmonary arterial hypertension: ACCP evidence-based clinical practice guidelines. Chest 2004;126(1Suppl): 35S-62S
3. Badesch DB, Abman SH, Simonneau G, et al. Medical therapy for pulmonary arterial hypertension: updated ACCP evidence-based clinical practice guidelines. Chest 2007; 131:1917-28
4. Simonneau G, Galie N, Rubin LJ, et al. Clinical classification of pulmonary hypertension. J Am Coll Cardiol 2004; 43(12 Suppl S): 5S-12S
5. Consensus statement on the management of pulmonary hypertension in clinical practice in the UK and Ireland. Heart 2008; 94: 1-41
Коментари към Лечение на пулмоналната артериална хипертония