Особености в лечението на саркоидоза
Хетерогенността на клиничните прояви, различната еволюция на болестта, както и проблемното определяне на прогнозата при даден пациент определят трудностите за стандартизиране на терапията. Освен това няма индикатор за активността на болестта. Многократно са правени опити да се установи корелация между билогичните (генетични или имунологични) и рентгенологичните данни и прогнозата на саркоидозата, но ползата от такива маркери остава да бъде установена в бъдеще.
Повечето терапевтични проучвания не ca добре рандомизирани и контролирани, което затруднява интерпретацията на публикуваните резултати. На практика цел на лечението при саркоидоза е да инхибира грануломатозната реакция, да не се допусне или да се редуцира функционалното увреждане на засегнатите органи и да се попречи на развитието на фиброза.
Оралната кортикостероидна терапия (КС) (Табл. 1) остава средство на избор и намалява неспецифично грануломатозната реакция, като инхибира редица цитокини (IL-1, IL-2, IL-12 и TNF-alpha). Кортикоидите са ефикасни при повечето прояви на саркоидозата, но с различна прагова доза при отделните пациенти в зависимост от състоянието на засегнатия орган. Други терапии се използуват само при непоносимост или контраиндикации към системни КС.
Таблица 1. Въпроси, на които трябва да се отговори преди решиние за лечение на саркоидоза.

Първият въпрос, който се задава, е дали КС са от полза при саркоидоза. Литературата от по-ранен етап доказва ефикасност от КС, но тези резултати поради етични съображения не са били сравнявани с плацебо. Впоследствие използването на системни КС е ограничено предимно за болните с хронична саркоидоза. Ако през 1950 г. няколко малки проучвания показаха полезния ефект от КС, то през 2007 г. широк метаанализ на използуването на КС при саркоидоза демонстрира подобрение в белодробната рентгенограма в сравнение с приложението на плацебо. Въпреки този резултат използването на КС не винаги подобрява здравето на пациента (Табл. 2). Процентът на лекуваните болни варира от 35 до 65% (Табл. 2), но при висок процент от пациентите КС продължават и след две години. В едно клинично проучване при повече от половината болни се е получил рецидив на болестта дори след този дълъг период на лечение и се е наложила отново терапия. Това показва важността на решението да се стартират КС. Когато се взема това решение, нужно е да се знае, че половината от тези болни ще се нуждаят от лечение за повече от две години. Това налага прецизна оценка за идентифициране на болните с по-агресивно протичане. Повечето от тези, които ще изискват терапия над две години, са с хронична форма на болестта и провеждат лечение с ниски дози КС. В редица от случаите тази доза не е достатъчна и с оглед избягване на токсичност се използват алтернативни на стероидите медикаменти.
Таблица 2. Изход от клиничното поведение при саркоидоза.

Интерес представляват резултатите от Американско проучване АССЕSS (A Case Controlled Etiologic Study of Sarcoidosis), което анализира информацията от десет центъра с новооткрита саркоидоза през последните шест месеца. Ключовите резултати показват: (1) повечето болни с персистираща болест над две години най-вероятно няма да получат резорбция на саркоидозата; (2) последен стадий на белодробна саркоидоза се развива след едно или две десетилетия; (3) използването на КС може да подпомогне развитието на рецидив при саркоидозно болни, когато медикаментът бъде спрян; (4) възможно е сигнификантни промени от белодробната рентгенограма да са налице без промени в стадия; (5) от всички болни 6% с 0, I или II стадий прогресират към стадий III и IV през наблюдавания двегодишен период; (6) болните с влошаваща се диспнея над две години много вероятно да имат едно или повече органни ангажирания; (7) от всички пациенти 23% развиват една или повече органни локализации след двегодишния период на наблюдение; (8) FVC, FEV1, рентгеновият стадий и диспнеята остават непроменени при около 20% от проследените болни през двегодишния период, докато приблизително 80% имат подобрение или стабилизиране на посочените параметри.
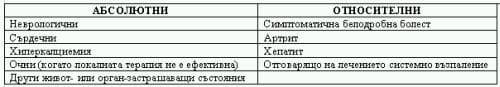
Важността за започване на КС наложи обединявани мнението на ATS/ERS/WASOG по отношение абсолютните индикации (Табл. 3).
Таблица 3. Индикации за лечение с кортикостероиди.
По отношение на белодробната локализация при болни с рентгенологичен стадий I (със или без еритема нодозум) и с нормална белодробна функция не се налага лечение с КС. Симптоматични пациенти с II, III стадий белодробни лезии и с нарушена белодробна функция отговарят на лечението с орални КС. Болните с новооткрита болест отговарят по-добре, отколкото тези, които имат саркоидоза за повече от две години. Все още не е ясно колко дълго трябва да продължи лечението, какви маркери да бъдат използвани за решението за снижаване на дозата и кога то да бъде спряно.
Инхалаторните КС се препоръчват за лечение на симптоми като кашлица, прояви на бронхиална обструкция и хиперсензитивност. Обаче това не винаги се подкрепя с клинично подобрение. Наблюдения показват, че началната индукционна терапия с орален prednisolon за три месеца, може да бъде последвана от инхалаторен budesonide за 18 месеца като алтернатива на поддържаща терапия през устата. Засега такъв положителен отговор се описва само когато е използван budesonide. Друг въпрос е как трябва да се предписват КС, когато няма отговор от приложената доза. Тъй като няма консенсус относно стартиращата доза на КС, препоръките са дозата да е в рамките на 30-40 mg/дневно prednisolon.
Екстрапулмоналната локализация е също трудна зона, за която няма данни в подкрепа на използване на КС, въпреки че често се прилагат. Препоръките са за използване, ако има органна недостатъчност или някаква друга абсолютна индикация.
Веднъж започната, терапията не трябва да се прекъсва, особено при болни с диагноза над две години. Обаче сега е ясно, че има група, при която няма да се стигне до рецидив, но все още не е ясно как да се идентифицират тези болни.
Алтернативно лечение
Антималаричните синтетични средства (chloroquine и hydroxychloroquine) се използват самостоятелно при кожни локализации, при нарушения на фосфорно-калциевия метаболизъм и според някои школи – при по-леки увреждания на белия дроб. Съобщава се за ефективност при белодробни случаи в дози, много по-високи от тези, които се приемат обичайно в практиката. В тези случаи ефектът често е забавен (3-6 месеца), което обяснява защо те не се използват в случаи, в които се очаква по-бързо възстановяване на функцията на засегнатия орган. Тези медикаменти могат да се използват като възможност за спестяване на КС, когато прагът на последните е нисък (< 10 mg cortison еквивалент)
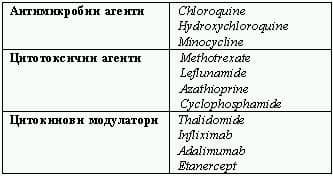
Има данни, че minocycline също е от полза при кожна саркоидоза, въпреки че все още са малко на брой съобщените случаи. За пациенти с хронично протичане алтернативно на КС лечение може да се категоризира в следните три области: антимикробни, цитотоксични агенти и цитокинови модулатори (Табл. 4)
Таблица 4. Категоризиране на алтернативите на кортикостероидната терапия при саркоидоза.
От супресивните средства methotrexate (10-15 mg/седмично) и azathioprine (150 mg/дневно) са основните терапевтични алтернативи в случай на абсолютна контраиндикация за КС. Те са особено полезни като средства, спестяващи КС при кортикозависими форми, или пък в съчетание с малки дози КС при твърде сериозни форми на саркоидоза. Обикновено те са добре поносими, но налагат грижливо наблюдение за своевременно откриване на потенциално сериозни странични ефекти.
Cyclophosphamide може да се опита при рефрактерни сърдечни и неврологични увреждания, но при млади пациенти се прилага много внимателно поради възможнастта да станат инфертилни или пък да се развие някаква малигнена патология. Необходимо е поне веднъж месечно изследване на урината във връзка с токсичност върху пикочния мехур. Напоследък се изоставя лечението с cyclosporine и chlorambucil. Специално cyclosporine не проявява ефект при белодробна саркоидоза, но има някои съобщения за полза при невросаркоидоза. Когато се предписва methotrexate, се проследяват данните на чернодробната и бъбречната функция. Препоръчително е началната доза да е 10 mg веднъж седмично и постепенно да се стигне при необходимост максимална доза от 15-20 mg/седмично. С оглед редуциране на токсичността може да се наложи спиране за известен период от време на медикамента и да се дава acidum folicum (1 mg/дневно). Дозата трябва да се редуцира при неутропенично болни.
Имуномодулаторът leflunamide дава пълен или частичен отговор при 80% от болните, като при очни прояви съвместното му приложение с methotrexate е дало по-добър отговор, отколкото прилагането само на единия медикамент.
Значимостта на TNF-alpha за формиране на туберкулозни и саркоидни грануломи доведе до предположението този цитокин да стане терапевтичен прицел при саркоидоза. Полиморфизмът на гена на TNF-alpha бе доказан с проучвания, показващи че алвеоларни макрофаги при болни с еволютивни белодробни форми продуцират по-големи количества в сравнение със стабилни форми. Освен това някои болни, които отговарят лошо на КС, имат персистираща алвеоларна продукция на TNF-alpha. Като анти-TNF- alpha специфичен медикамент е опитван pentoxyphilline, който има силна активност против TNF, но практически не е така ефикасен в дози, които лесно се понасят от храносмилателния тракт.
Thalidomide инхибира секрецията на TNF- alpha, освободен от алвеоларните макрофаги, и тази на IL-12. С успех се използва при рефрактерни кожни форми, но страничните му действия (особено тератогенните) ограничават употребата му при млади лица. Thalidomide има сигнификантно противовъзпалително действие, което е използвано главно при лечение на Micobacterium tuberculosis и лепра. Използването му подкрепя концепцията, че TNF може би е важен медиатор при саркоидоза. Thalidomide е използван за лечение на 15 болни с lupus pernio, която е хронична форма на болестта и е с минимален шанс за спонтанно обратно развитие. При доза 100 mg/дневно е показал много добър отговор, но и сигнификантни странични ефекти като сомнолентност и периферна невропатия. За съжаление не е ефективен при други органни локализации на саркоидоза.
Много са въпросите около три от медикаментите, специфично блокиращи TNF, каквито са etanercept, infliximab и adalimab. Etanercept, като TNF-рецепторен антагонист, прилаган подкожно, показва ефективност при ревматоиден артрит, но не и при болестта на Crohn. Той не е показал ефективност при 17 болни с II и III стадий на саркоидоза. При болни с очна саркоидоза, коита не отговарят на лечение с methotrexate, допълнителното включване на etanercept не води до съществени различия с групата плацебо. Infliximab, като моноклонално антитяло, прилагано интравенозно, показва ефективност при ревматоиден артрит и болестта на Crohn. В едно ретроспективно проучване, сравняващо анти-TNF-агенти при саркоидоза, при която е прилаган един от тези препарати (еtanercept, infliximab или adalimab), най-висок отговор е постигнат с infliximab (85%), докато при другите два отговорът е около 30%. Анти-TNF-терапията е сигнификантно токсична. Вече се натрупаха доста наблюдения за ефекта на infliximab при имуносупресивно лечение на рефрактерна саркоидоза. Това лечение е обикновено добре понасяно с изключение на случаи с развитие на синдром на хиперкоагулабилитет, алергични реакции (рядко анафилаксия), изискващи внимателно наблюдение по време на инфузия. Налице е също увеличен риск от инфекция и особено от реактивация на туберкулоза. Допълнително анти-TNF-терапията увелечава риска от смъртност при болни, имащи вече напреднал стадий на конгестивна сърдечна недостатъчност. Съмненията за увеличен риск от малигнитет са все още неизчистени поради липса на подкрепящи данни. Използването на това скъпо лечение трябва да бъде запазено за твърде тежките клинични форми на саркоидоза и да бъде провеждано в специализирани центрове с опит. Преди употреба е важно да се търсят бактериална или микозна (по-специално аспергилозна) колонизация, която е честа при еволюирали форми на белодробна саркоидоза.
В светлината на придобитите нови знания за патогенезата към изпитваните антирецептори на хемокините трябва да се подхожда все още предпазливо, тъй като един медиатор в началото може да има благоприятен ефект върху грануломатозната реакция, докато персистиращата му хронична секреция може да бъде смъртоносна. Такъв е случаят с TSF-beta, който може да благоприятства инволюцията на Th1-отговора при саркоидоза, но същевременно в друг момент може да допринесе за фиброзна реакция, която съпътства някои грануломи.
На практика трябва да се отчита уникалната способност на саркоидозата в голям процент от случаите да търпи спонтанно обратно развитие. Въпреки предлаганите многобройни терапевтични възможности е необходимо да се съобразяваме с девиза на Хипократ: „Преди всичко да не се вреди”.
При лечение на саркоидоза насоката е преди всичко да се избере подходящо лекарство за всеки болен. В терапевтичното поведение навлиза подходът за използване на повече агенти, а не за се разчита на едно лекарство. Понастоящем медиците имат на разположение множество лекарства, които могат да бъдат прилагани според разнообразните патогенетични механизми, участващи при това заболяване.
Доц. д-р Стоян Иванов, СБАЛББ „Св. София”, София
Литература
1. Иванов С. Саркоидоза и други грануломатози. Монография, София 2000
2. Judson AM, et al. Sarcoidosis. Diffuse lung disease, 2004
3. Baughman PT. Therapevtic options for sarcoidosis. ETS Annual Congres, Copenhagen, 2005
4. Drent M. Sarcoidosis. Eur Respir J 2005
5. Newman S, et al. Sarcoidosis. Prognosis in Respiratory Research 2007; 36
Коментари към Особености в лечението на саркоидоза