Пулмонална артериална хипертония и белодробно сърце при синдром на обструктивна сънна апнея
Терминът дихателни нарушения по време на сън (ДНВС) обединява група състояния, които се характеризират с увреждане на дихателната регулация по време на сън. Към тези заболявания се отнасят протичащите с обструкция на горни дихателни пътища (ГДП) – обструктивна сънна апнея и обструктивно хъркане, както и такива без обструкция на ГДП, като централна сънна апнея, първична и вторична алвеоларна хиповентилация.
Дихателните нарушения по време на сън се срещат сравнително често. Заедно с нарушенията на архитектониката на съня, намаляване на дълбокия сън, нарушения на бодростта, кондицията и възможността за концентрация, апноичните паузи по време на сън имат редица остри или хронични кардиваскуларни последици. Откакто Gastaut et al. описват през 1966 г. интермитентната нощна обструкция на дихателните пътища при възрастни със синдром на Pickwick, в научната литература проблемът за сърдечносъдовите усложнения при дихателни нарушения по време на сън при възрастни се дискутира усилено. Като последица и придружаващи болести при пациенти с ДНВС влизат в съображение пулмоналната хипертония (ПХ), хроничното белодробно сърце, артериалната хипертония, кардиомегалията, спазъмът на коронарните артерии и коронарната сърдечна болест, нарушенията на сърдечния ритъм, инсултите и т.нар. сърце при сънна апнея3, 4, 5, 6, 7, 8, 9, 37, 38. При това може да се достигне до артериална хипертония, като детерминанта на лявокамерното следнатоварване, до промяна в минутния сърдечен обем и сърдечната честота, както и (вероятно поради лявокамерната хипертрофия или налична коронарна сърдечна болест) до ограничаване на коронарния кръвоток15. В рамките на клинични проучвания е установено, че хипоксията и промените в налягането на гръдната клетка по време на апноичните паузи, които в зависимост от тежестта на заболяването могат да бъдат значими, водят до повишаване на налягането в белодробната артерия. В голяма част от проучванията едва при 20% от пациентите може да се докаже персистираща през деня манифестна пулмонална артериална хипертония (ПАХ) и белези за десностранно сърдечно натоварване, като доскоро не беше установена пряка взаимовръзка между нощните фази на апнея и хипопнея и ПАХ.
Дефиниция и епидемиология на ДНВС
С понятието ДНВС се обозначават различни болести, при които е налице нарушена регулация на дишането по време на сън. ДНВС се разделят на две големи групи: (1) обструктивни дихателни нарушения по време на сън, които протичат с парциална или пълна обструкция на ГДП и (2) необструктивни дихателни нарушения (Табл. 1)16.
Таблица 1. Дихателни нарушения по време на сън.

Следващите заключения се отнасят до обструктивни ДНВС, при които могат да са налице фази на апнея и хипопнея с продължителност до 80 и повече секунди и кислородна десатурация до 60% и по-малко, обуславящи нарушение на ритъма на съня, адренергична стимулация и микрoсъбуждания (arousal).
Тежестта на заболяването се определя от честотата на апнеите и хипопнеите за един час сън или от индекса апнея/хипопнея (АНI/h), при което липсва зависимост между тежестта на апнеята и нивото на кислородна десатурация. Показателят AHI корелира обаче с повишена (обусловена от сърдечносъдови събития) смъртност18. Водещите клинични симптоми на обструктивната сънна апнея (ОSAS) са резултат на нарушения нощен сън: умора, понижена работоспособност, дневна сънливост и императивна нужда от сън, водеща до заспиване при необичайни обстоятелства, сутрешно главоболие, което се дължи на ретенция на СО2 през нощта, неравномерно и силно хъркане, съответстващо на парциалната обструкция на ГДП. В зависимост от критерия АНI честотата на ОSAS се движи между 2% при жени и 4% при мъже в трудоспособна възраст24, 61. При пациенти с артериална хипертония или коронарна сърдечна болест ДНВС се установяват при 40% от всички пациенти. Подобни данни се установяват и при по-възрастни.
Функция на сърдечносъдовата и дихателната система по време на сън
Сънят се харектеризира с последователност от различни стадии и променяща се активност на автономната нервна система. Според Rechtschaffen се различават няколко стадия на съня, при което стадий I има продължителност около 10 минути и преминава във II стадий, характеризиращ се електроенцефалографски с тета-активност, К-комплекси и сънни вретена. Дълбоките стадии на съня (III и IV) настъпват при здрави след около 15 минути от началото на съня и се прекъсват от REM- фазите на съня, характеризиращи се с бързи очни движения. В ранните сутрешни часове дълбоките стадии на съня намаляват за сметка на увеличаването на REM-съня. При здрави хора по време на сън се наблюдава редукция на дихателните усилия, обусловена от понижената чуствителност на хеморецепторите и последваща хиповентилация, но без съществена промяна в кислородната сатурация. Сърдечната честота, минутният сърдечен обем и артериалното налягане се понижават, а пулмоартериалното налягане (ПАН) вероятно се повишава в зависимост от позицията19. Тези промени са различно изявени по време на различните стадии на съня, като по време на т.нар. парадоксален REM-сън се наблюдава транзиторна адренергично медиирана промяна в посока към повишаване на кръвното налягане и минутния сърдечен обем19.
Остро въздействие на фазите на обструктивна апнея върху белодробното кръвообращение – хипоксия и хиперкапния
Още през 1946 г. при експериментални опити при животни и при хора е описана вазоконстрикцията на белодробната артерия, индуцирана от хипоксемия, която води до нарушена перфузия на невентилираните белодробни сегменти. С това се предотвратяват вентилаторно/перфузионните нарушения (V/Q). Тъй като тази реакция се наблюдава и доказва върху изолирани белодробни препарати21 и след белодробна трансплантация22, автономната инервация вероятно има малко каузално значение в този аспект. Още повече, когато става дума за хипоксична вазоконстрикция и за вероятно модулиране на реакция на локално образуване на азотен окис (NO) и ендотелин в областта на прекапилярните белодробни съдове23, 24. При пациенти със сънна апнея осъществените изследвания на венозните съдове на предмишницата показват понижена вазодилатация, индуцирана от NO. Така че при наличие на хипоксемично-обусловена, адренергично-медиирана вазоконстрикция локалната (медиирана от NO) вазодилатация може би незадоволително се компенсира. Най-общо, значението на съдовия ендотел за регулация на ПАН и системното артериално налягане при пациенти с ОSAS все още не е достатъчно добре изяснено25. Предполага се обаче, че повтарящите се нощни десатурации, наблюдавани при пациенти с ОSAS, водят до хипоксично обусловено повишаване на ПАН – феномен, който многократно е бил наблюдаван. Резултатите от експериментални и клинични проучвания, касаещи възможното повишаване на белодробното артериално налягане в резултат на повтарящи се апноични фази, са некохерентни39. Наблюдаваните в рамките на експерименти с животни, обдишвани интермитентно с хипоксична газова смес, както и описаното от Sforza et al. прогресивно повишаване на ПАН към края на нощта при пациенти със сънна апнея не се потвърждава от други автори26, 27. Още повече, че повишените стойности на ПАН се наблюдават предимно в края на апноичните фази и не са достатъчно добре обясними само с наличието на интермитентна хипоксия. В този смисъл от голямо значение са изследвания при пациенти с фази на централна апнея, при които не се наблюдава хипоксично обусловено повишаване на ПАН. Освен това подаването на кислотод по време на сън на пациенти с ОSAS не води до очакваното понижаване на ПАН. Наред с това при индивиди, които хъркат, имат парциална обструкция на ГДП и е изключено наличието на ОSAS, респективно нощна хипоксия, се наблюдават повишени стойности на налягането в белодробното кръвообръщение42.
Laks et al. документират значимо повишаване на ПАН по време на еукапнична хипоксия, както при пациенти с ОSAS, така и при здрави28. Тъй като при различните индивиди са били налице индивидуални модели на реакция, не е описана директна връзка между тежестта на сънната апнея и хипоксемично индуцираното повишаване на ПАН. Доколко повече или по-малко изразената хипоксемична вазоконстрикция е генетично детерминирана, все още е спекулативен въпрос.
Интраторакални колебания в налягането
За разлика от периферното кръвообръщение, белодробното се характеризира не само с артерио-венозна разлика в налягането, но и със зависимост от белодробните обеми, алвеоларното и интрапулмоналното налягане29. По време на вдишване се понижава интраторакалното налягане (с едновременно повишаване на абдоминалното налягане и повишено венозно връщане към дясно сърце). Според Maseri големите белодробни съдове (поради ограничения си комплаянс) са само условно в състояние да компенсират обемните колебания30. Повишаването на белодробния кръвоток става възможно предимно за сметка на областите с малки алвеоларни съдове, които в голямата си част са повлияни от взаимоотношенията с белодробния паренхим и промените в налягането. При пациенти с ОSAS наличието на екстраторакална обструкция на дихателните пътища може да доведе до изразено покачване на негативното интраплеврално налягане, което може в определени случаи да надвиши 80 cm H2O при запазване на белодробните обеми (маньовър на Müller). Изследването на белодробния кръвоток и трансмуралното белодробно-артериално налягане (PTM) (изчислява се от разликата между ПАН и интраторакалното, респективно езофагеалното налягане) показва повишаване както на PTM, така и на белодробното съдово съпротивление (PVR). Колебанията в интраторакалното налягане покачват PCW и повлияват негативно лявокамерното пълнене, което се документира в късните фази на апнея11. Във връзка с повишения дяснокамерен ударен обем се установява нарушение на белодробното венозно оттичане.
Лявокамерна функция и дясно-леви интеракции
В резултат на обратния венозен кръвоток и увеличения дяснокамерен ударен обем при пациентите със сънна апнея, при които липсват данни за сърдечносъдови рискови фактори през деня, може да се установи увреждане на лявокамерната функция, особено когато са описани диастолни контрактилни нарушения31. Тези ранни манифестации на лявостранна сърдечна недостатъчност се наблюдават както при инвазивно изследване, документиращо пулмо-капилярното налягане и посткапилярната белодробно-артериална хипертония, така и по време на ехокардиографско изследване (Ехо-КГ), когато се установява избутване на септума към лява камера при почти 50% от пациентите с доказуема асиметрична хипертрофия на септум14. По време на микросъбуждането (arousal) са доказани и други реакции на адренергична стимулация, които биха могли да доведат до повишаване на лявокамерното следнатоварване и по този начин да засилят функционалното лявокамерно нарушение. По този начин лявокамерната дисфункция представлява важна съставка на нарушение, която (заедно с повишеното през нощта ПАН) се наблюдава при пациенти с ОSAS.
Пулмонална хипертония през деня
Много проучвания документират, че при 17-41% от пациентите с OSAS се регистрира леко изразена ПАХ със СПАН – 25 mm Hg през деня, което прави вероятна честота на това нарушение около 20%14, 32, 33, 34. Високото ниво на разпространение се обяснява в голяма степен с факта, че в проучванията са включени различни групи от пациенти с нехомогенно разпределение на съпътстващите белодробни и сърдечни болести и са използвани различни методи на изследване. По-голямата част от проучванията не доказва връзка между степента на тежест на сънната апнея, изразена посредством изчисляването на AHI и изразеността на ПАХ през деня. Само в рамките на две проучвания се предполага връзка между АНI и ПАХ през деня12, 35. Неоспорими важни причини, манифестиращи повишено ПАН през деня, са дихателната недостатъчност, редукцията на форсирания експираторен обем за една секунда (FEO1), като доказателство на Overlap-Syndrom и съпровождащо лявокамерна сърдечна болест7.
Дихателна недостатъчност (ДН) през деня
Персистирането на ДН през деня, която посредством механизмите на хипоксична вазоконстрикция вероятно води до прекапилярно повишаване на налягането в белодробните съдове, има като причина редукция на хемосензитивността, разглеждана като адаптационен механизъм при наличие на нощна хипоксия. Тази редукция е обратима и се нормализира в хода на лечение с постоянно позитивно налягане (nСРАР).
При около 70% от пациентите с дихателни нарушения по време на сън е налице затлъстяване, съпроводено с рестриктивни вентилаторни нарушения, повишени изисквания към механиката на дишане и понижена сензитивност на хеморецепторите. Различни изследвания показват значително повишение на бодимас-индекса (ВМI) при пациенти с ПАХ и ОSAS12.
ХОББ (Overlap-Syndrom)
При пациенти с OSAS и ПАХ много често като придружаващо заболяване се установява наличие на ХОББ36. При 11-26% от всички индивиди с OSAS се описва наличието на Overlap-Syndrom. При пациенти, при които са налице леко изразени обструктивни вентилаторни нарушения, се установява повишено ПАН. В този аспект наличието на OSAS се определя като важен фактор, който заедно с хроничното белодробна болест засилва неблагоприятните ефекти върху белодробното кръвообръщение11, 40.
Нарушение на лявокамерната функция
При около 70% от пациентите с OSAS се регистрират повишени стойности на системното артериално кръвно налягане, измерени през деня, в смисъл на вторична хипертония. Като причина за артериалната хипертония (наред със съпътстващите сърдечносъдови рискови фактори, като затлъстяване и хиперлипидемия) се разглежда и повишената концентрация на циркулиращи плазмени катехоламини, както през деня, така и през нощта, дължащи се на повишената адренергична стимулация30. В резултат от настъпващите функционални нарушения на лява камера и възникването на хипертонично сърце при 37% от пациентите може да бъде установена посткапилярна ПХ. При това латентно повишеното ПАН първоначално може да бъде обусловено от лявокамерно обременяване. Трябва да се отбележи, че в много проучвания, включващи голям брой пациенти, не са документирани всички хемодинамични параметри и поради това сравнителната оценка на пулмо-капилярното налягане е само условно възможна21, 36.
Преустройство на съдовете в белодробното кръвообръщение
Днес нови проучвания документират промените в малкия кръг на кръвообръщение, които не се дължат на белодробна болест, а са следствие или на посткапилярна хипертония, или в случаите на нормална лявокамерна функция имат връзка с наличието на OSAS33, 41. Авторите доказват възможността за ремоделиране на съдовете, като последица от нощната хипоксемия – факт, доскоро демонстриран само върху животински модели. Laks et al. предполагат наличие на генетично детерминирана чувствителност на белодробните съдове към хипоксия, която е различно изразена42. Досега обаче все още не е изяснено в кой момент на заболяването се проявява ремоделирането на съдовете и дали морфологичните промени в белодробните артерии са единствената функционална причина, водеща до промените в белодробното кръвообръщение.
Белодробно сърце (cor pulmonale)
Белодробното сърце се дефинира като хипертрофия и дилатация на дясната камера, настъпили в резултат на функционални и структурни промени в белодробните съдове, които влошават прогнозата на пациенти с ХОББ. За сега все още е неясно доколко протичането на OSAS се определя от натоварване на дясното сърце. Поради повишаване на венозното връщане и покачване на ПАН (като детерминанти на дяснокамерното следнатоварване по време на апноичната пауза) дясната камера е подложена както на обемно, така и на пресорно натоварване. Поради изразената адаптационна способност на дясната камера към хронично обемно и пресорно колебание персистиращите през деня промени имат важно прогностично значение. Khalil и Rifaie доказват ЕКГ-промени при 79% от пациентите с OSAS, свидетелстващи за дяснокамерно обременяване, но също така и за лявокамерна хипертрофия43. Ехокардиографското изследване показва хипертрофия на стената на дясна камера при 71% от пациентите, като израз на рецидивиращо обременяване на дясното сърце. Болни с документирана дяснокамерна хипертрофия се отличават с по-висок АНI и комулативна продължителност на нощните апнеи, както и със значима кислородна десатурация. Установява се зависимост между тежестта на сънната апнея и дяснокамерната хипертрофия2. Заедно с морфологичните промени в стената на дясна камера при около 30% от пациентите с OSAS е установена редуцирана дяснокамерна помпена функция с метода на радионуклидна вентрикулография. Nahmias et al. наблюдават покачване на фракцията на изтласкване на дясна камера от 30% на 39% под въздействие на лечение с nCPAP44. Въпреки честите морфогенетични и функционални промени, клиничните данни за дяснокамерна декомпенсация при пациенти с OSAS са сравнителна редки. Само при 12% от изследваните пациенти с ехографски доказана дяснокамерна хипертрофия Bradly et al. установяват периферни отоци и застойни шийни вени6. Тези пациенти се различават по тежестта на наличната дяснокамерна недостатъчност, но не и по величината на АНI. В заключение, при около една трета от пациентите с OSAS при изследване през деня могат да се докажат налични морфологични и функционални промени в дясна камера. По-късно се явява хипертрофия (индуцирана от хипоксията и големите колебания в наляганията и обемите), която може в крайна сметка да доведе до ограничавне на дяснокамерната функция. Въпреки тези промени дяснокамерната декомпенсация се среща рядко и вероятно се дължи по-скоро на дихателна недостатъчност, отколкото на тежестта на обструктивната сънна апнея.
Диагностични и терапевтични алгоритми
Поради високата честота на OSAS наличието на артериална хипертония или ПАХ, свързана с хъркане, се явява индикация за диагностично уточняване. От друга страна, при пациенти с диагностицирана OSAS е необходимо Ехо-КГ изследване за преценка на сърдечната помпена функция и установяването на хипертрофия. Функционалното изследване на дишането може да установи наличие на ХОББ, а изследването на артериалните кръвни газове дава отговор за налична дихателна недостатъчност – фактор, оказващ въздействие върху белодробното артериално налягане и върху дясната камера.
Лечение на OSAS
Тъй като причината за възникването на обструкция на ГДП при OSAS все още не е изяснена, липсва каузално лечение. Цел на симптоматичното лечение при OSAS е преодоляване на дихателните паузи, явяващи се по време на сън, и свързаните с тях сърдечносъдови и невропсихичнни последици, както и редуциране на смъртността16. Предпоставки за това са поставяне на точна диагноза и добър къмплаянс от страна на пациентите.
На Табл. 2 са представени общите мерки и медикаментозното лечение при пациенти с ДНВС, които имат ограничена ефективност. С малки изключения болните са показани за лечение и контрол в дългосрочен план16. Приложението на theophyllin има ограничено приложение при наличие на Overlap-Syndrom (при пациенти с централни апнеи) поради централното си действие, стимулиращо дихателния център. Самостоятелно приложение на кослородотерапия по правило не довежда до редукция на апноичните паузи и свързаното с тях повишено ПАН, но при наличие на съпътстваща ХОББ адювантната кислородна терапия е уместна при персистиране на хипоксията в хода на лечението с nCPAP (Табл. 2).
Tаблица 2. Лечение на OSAS.
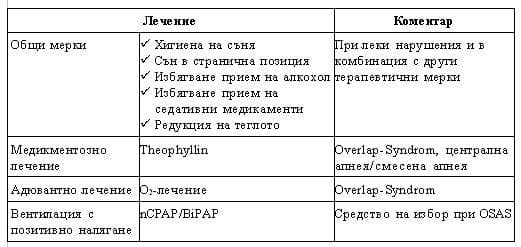
Днес златен стандарт за лечението на OSAS се явява неинвазивната вентилация с назален СРАР. Нивото на прилаганото налягане трябва да бъде определено и титрирано в хода на полисомнографски контрол. При необходимост от високи налягания се налага понижаване на експираторното налягане и предпочитаният модус на вентилация е bilevel-positive-airway-pressure (BIPAP).
Лечение на ПАХ и белодробно сърце
За повлияване на ПАХ е необходимо оптимално лечение на подлежащата основна болест. За разлика от вентилацията със СРАР и BIPAP, за които има доказателства, че повлияват ПАХ, за теофилиновите препарати, такива липсват. Ефективността на кислородната терапия върху ПАХ при пациенти с OSAS актуално не може да бъде оценена, въпреки че, изхождайки от патофизиологичните основи, не би трябвало да се очаква повлияване без въвеждане на адекватна терапия с nCPAP. Пациенти с Overlap-Syndrom се повлияват най-добре от комбинирана терапия: вентилация със СРАР/BIPAP и кислородотерапия.
Заключение
Синдромът на OSAS има широко разпространение сред популацията. Хипоксията и промените в интраторакалното налягане в гръдната клетка, които се наблюдават по време на апноичните фази, хипертоничното сърце и лявокамерната дисфункция водят до развитието на ПАХ. При всеки пети пациент се установява леко повишено белодробно артериално налягане в будно състояние, през деня. Важни фактори, оказващи въздействие върху налягането в белодробната артерия, се явяват съпътстващата дихателна недостатъчност, подлежащата хронична белодробна болест и функционалните нарушения на лява камера, които се характеризират с наличие на разнообразни рискови фактори. Тежестта на OSAS няма водещо значение като причина за ПАХ. Въз основа на хемодинамичните промени и нощните хипоксии при две трети от пациентите с OSAS се откриват данни за дяснокамерна хипертрофия и функционални нарушения от типа на белодробно сърце при изследване в будно сътояние през деня. Терапевтичният подход при пациенти с ДНВС включва оптимално лечение на основното заболяване с помощта на вентилация в различни модуси според индивидуалната необходимост. Медикаментозното лечение, както на ДНВС, така и на съпътстващата ги ПАХ, има незначителна ефективност и приложение.
Диана Петкова, д-р, гл. асистент, Клиника по пневмология и фтизиатрия, МБАЛ „Св. Марина” – Варна, Медицински университет – Варна
Литература
1. Gastaut H, Tassinari A, Duron B. Polygraphic study of the episodic diurnal and nocturnal (hypnic and respiratory) manifestations of the Pickwick syndrome. Brain Res 1966; 2:167-186
2. Konermann M, Sanner B, Sturm A: Schlafbezogene Atmungsstbrungen und assoziierte kardiovaskulаеre Erkrankungen. Med Klin 1995; 90: 480-485
3. Hedner J, Ejnell H, Caldahl K. Left ventricular hypertrophy independent of hypertension in patients with obstructive sleep apnea. J Hypertens 1990; 8: 941-946
4. Koehler U, Becker H, Borrmann R, Faust M, Hirnmelmann H, Liesendahl K, Peter JH, von Wichert P. Das EKG bei Patienten mit schlafbezogenen Atemregulationsstrrungen – seine Stellung in Diagnostik und Therapie. Prax Klin Pneumol 1987; 41: 380- 384
5. Liam CK. Cor pulmonale due to obstructive sleep apnea. Med J Malaysia 1993; 48: 347-350
6. Netzer N, Wemer P, Jochums I, Lehmann M, Strohl KP. Blood flow of the middle cerebral artery with sleep-disordered breathing: correlation with obstructive hypopneas. Stroke 1998; 29: 87-93
7. Riess M, Koehler U, Gueldenring I, Naumann-Koch C, Petеr JH, Ploch T, Stellwaag M, Blanke H, von Wichert P. Ergebnisse der Linksherzkatheteruntersuchung bei 64 Patienten mit nаеchtlichen Atemregulationsst6rungen (Schlafapnoe). Pneumologie 1989; 43: 611-615
9.. Sanner B, Sturm A, Konermann M. Koronare Herzerkrankung bei Patienten mit obstruktiver Schlafapnoe. Dtsch Med Wschr 1996;121: 931-935
10. Berman EJ, DiBenedetto RJ, Causey DE, Mims T, Conneff M, Goodman LS, Rollings RC. Right ventricular hypertrophy detected by echocardiography in patients with newly diagnosed obstructive sleep apnea. Chest 1991; 100: 347-350
11. Bonsigore MR, Marrone O, Insalaco G, Bonsignore G. The cardiovascular effects of obstructive sleep apnoeas: analysis of pathogenic mechanisms. Eur Respir J 1994; 7: 786-805
12. Chaouat A, Weitzenblum E, Krieger J, Oswald M, Kessler R. Pulmonary hemodynamics in the obstructive sleep apnea syndrome.Results in 220 consecutive patients. Chest 1996; 109: 380-386
13. Hanly P, Sasson Z, Zuberi N, Lunn K. ST – Segment depression during sleep in obstructive sleep apnea. Am J Cardiol 1993; 71: 1341-1345
14. Laaban JP, Cassuto D, Orvoen-Frija E, Iliou MC, Mundler O, Leger D, Oppert JM. Cardiorespiratory consequences of sleep apnoea syndrome in patients with massive obesity. Eur Respir J 1998; 11: 20-27
15. Chen L, Scharf SM. Systemic and myocardial hemodynamics during periodic obstructive apneas in sedated pigs. J Appl Physiol 1998; 84: 1289-1298
16. Kryger M, Roth T, Dement WC. Principles and Practice of Sleep Medicine. Phyladelphia, WB Saunders Company, 1989, 2005
17. Young T, Palta M, Dempsey J, Skatrud J, Weber S, Badr S. The occurrence of sleep-disordered breathing among middle-aged adults. N Engl J Med 1993; 328(17): 1230-5
18. He J, Kryger MH, Zorick FJ, Conway W, Roth T () Mortality and apnea index in obstructive sleep apnea. Chest 1988; 94: 9-14
19. Khatari IM, Freis ED. Hemodynamic changes during sleep. J Appl Physiol 1967; 22: 867-873
20. Kiely JL, McNicholas WT. Cardiovascular risk factors in patients with obstructive sleep apnoea syndrome. Eur Respir J 2000; 16: 128-133
21. Hauge A, Melmon KL. Role of histamine in hypoxic pulmonary hypertension in the rat. II. Depletion of histamin, serotonin, and catecholamines. Circ Res 1968; 22: 385-392
22. Robin ED, Theodore J, Burke CM, Oesterle SN, Fowler MB, Jamieson SW, Baldwin JC, Morris AJ, Hunt S, Vankessel A, Stinson EB, Shumway NE. Hypoxic pulmonary vasoconstriction persists in the human transplanted lung. Clinical Science 1987; 72: 283-287
23. Curzen NP, Evans TW. Modulation of pulmonary vasculator tone in ARDS: The role of the endothelium. Pinsky MR, Dhainaut JF, Artigas A. The pulmonary circulation: Moving from passive to active control. Saunders, London, 1996, S 77-105
24. Kato M, Staub NC. Response of small pulmonary arteries to unilobar hypoxia and hypercapnia. Circ Res 1966; 19: 426-439
25. Fletcher EC. Sympathetic activity and blood pressure in the sleep apnea syndrome. Respiration 1997; 64: 22-28
26. Sforza E, Laks L, Grunstein RR, Krieger J, Sullivan CE. Time course of pulmonary artery pressure during sleep apnoea syndrome: role of recurrent apnoeas. Eur Respir J 1998; 11: 440-446
27. Schäfer H, Hasper E, Ewig S, Koehler U, Latzelsberger J, Tasci S, Lüderitz B. Pulmonary haemodynamics in obstructive sleep apnoea: time course ans associated factors. Eur Respir J 1998; 12: 679-684
28. Laks L, Lehrhaft B, Grunstein RR, Sullivan CE. Pulmonary artery pressure response to hypoxia in sleep apnea. Am J Respir Crit Care Med 1997; 155: 193-198
29. Permutt S, Bromberger-Barnea B, Bane HN. Alveolar pressure, pulmonary venous pressure and the vascular waterfall. Med thoracalis 1962; 19: 239-260
30. Widimsky J, Daum S, Herzog H. Progress in respiratory research. Karger, Basel 1970, S53
31. Martinez D, Lenz MC, Souza AH, Silva DG. Daytime left ventricular dysfunction measured echocardiographically in patients with severe obstructive sleep apnea syndrome. Chest 1997; 112: 10S
32. Kessler R, Chaouat A, Weitzenblum E, Oswald M, Ehrhart M, Apprill M, Krieger J. Pulmonary hypertension in the obstructive sleep apnoea syndrome: prevalence, causes and therapeutic consequences. Eur Respir J 1996; 9: 787-794
33. Sanner B, Doberauer C, Konermann M, Sturm A, Zidak W. Pulmonary hypertension in patients with obstructive sleep apnea syndrome. Arch Intern Med 1997; 157: 2483-2487
34. Weitzenblum E, Krieger J, Apprill M, Vallee E, Ehrhart M, Ratomaharo J, Oswald M, Kurz D. Daytime pulmonary hypertension in patients with sleep apnea syndrome. Am Rev Respir Dis 1988; 138: 345-349
35. Sanner B, Konermann M, Müller HJ, Grötz J, Laschewski F, Kreuzer I. Rechtsventrikuläre Funktion bei Patienten mit einer obstruktiven Schlafapnoe. Wien med Wschr 1995; 145: 518-520
36. Krieger J, Sforza E, Apprill M, Lampert E, Weitzenblum E, Ratomaharo J. Pulmonary hypertension, hypoxemia, and hypercapnia in obstructive sleep apnea patients. Chest 1989; 96: 729-737
37. McNicholas WT, Bonsigore MR. Management Committee of EU COST ACTION B26. Sleep apnoea as an independent risk factor for cardiovascular disease: current evidence, basic mechanisms and research priorities. Eur Respir J 2007; 29: 156-178
38. Marin J, Carrizo S, Vicente E, Agusti A. Long-term cardiovascular outcomes in men with obstructive sleep apnoea-hypopnoea with or without treatment with continuous positive airway pressure: an observational study. The Lancet 2000; 365: 1046-1053
39. Perry JC, D’Almeda V, Souza FG, Schoorlemmer GH, Colombari E, Tufik S. Consequences of subchronic and chronic exposure to intermittent hypoxia and sleep deprivation on cardiovascular risk factors in rats. Respir Physiol Neurobiol 2007; 156(3): 250-8
40. Fletcher EC, Schaaf JW, Miller J, Fletcher JG. Long-term cardipulmonary sequelae in patients with sleep apnea and chronic lung disease. Am Rev Respir Dis 1987; 135: 525-533
41. Sajkov D, Cowie RJ, Thornton AT, Espinoza HA, McEvoy D. Pulmonary hypertension and hypoxemia in obstructive sleep apnea syndrome. Am J Respir Crit Care Med 1994; 149: 416-422
42. Laks L, Lehrhaft B, Grunstein RR, Sullivan CE. Pulmonary artery pressure response to hypoxia in sleep apnea. Am J Respir Crit Care Med 1997; 155: 193-198
43. Khalil MM, Rifaie OA. Electrocardiographic changes in obstructive sleep apnoea syndrome. Respir Med 1998; 92: 25-27
44. Nahmias J, Lao R, Karetzky M. Right ventricular dysfunction in obstructive sleep apnea: reversal with nasal continuous positive airway pressure. Eur Respir J 1996; 9: 945-951

Коментари към Пулмонална артериална хипертония и белодробно сърце при синдром на обструктивна сънна апнея