Фотодерматози - диагностика и лечение

Ултравиолетовите (UV-) лъчи имат дължина на вълната, по-къса от тази на видимия спектър. Те са високоенергийни, в състояние са да разкъсват химичните връзки, да правят молекулите необичайно реактивни и да се йонизират, като променят взаимното си поведение. UV- радиацията има разрушителен ефект при предозиране и води до изгаряне на кожата, но и при повтарящи се субдози е доказан мутаген, като УВ-режда ДНК-молекулите в клетките и е причина за стареенето на кожата и кожната карциногенеза.
Дълго време се приемаше, че кожните промени, предизвиквани от слънчевата радиация, се дължат на UV-B лъчите. Сега е известно, че сериозна роля в тази насока имат не само UV-A лъчите, но също видимата светлина и инфрачервените лъчи. Рискът от неблагоприятното въздействие на UV-A лъчите е висок, тъй като те представляват 90% от UV-спектъра, налични са през цялата година, проникват през стъклата на прозорците, облаците, тънките дрехи, преминават през филтрите, предпазващи от UV-B лъчи и достигат до дълбоките слоеве на дермата, докато над 90% от UV-B лъчите се поглъщат от роговия слой на епидермиса и въздействат главно върху неговите клетки (10, 13).
Фотодерматозите в исторически план
Първата фотодерматоза (описана от Robert Willan през 1798 г.) е eczema solare. Със същия термин в 1887 г. Veiel назовава болестно състояние, чието описание отговаря по-скоро на полиморфната светлинна ерупция, което название е официално заявено от Rasch в Копенхаген през 1900 г. Тази дерматоза е описана и като prurigo aestivalis от Jonathan Hutchinson в 1878 г., а в 1919 г. Haxthausen използва термина полиморфна светлинна ерупция (Polymorphous light eruption) като събирателен за eczema solare и prurigo aestivalis поради трудното диференциране на двете болестни състояния. Hydroa vacciniforme е описана от Bazin в 1860 г., а след това някои автори объркващо употребяват това название за болестната картина на конгениталната porphyria erythropoetica. Moriz Kaposi описва xeroderma pigmentosum в 1870 г. без обаче да дефинира връзката със слънчева експозиция, което много по-късно е направено от Paul Unna (по 10).
Конгениталната porphyria erythropoetica е получавала различни наименования през годините в края на XIX и началото на XX век, като причинната връзка със светлината е отбелязана от M’Call Anderson в 1898 г. Зависимостта на появата на кожни лезии от светлинна експозиция на порфирини е лансирана от Ehrmann в 1909 г., но едва в 1911 г. Günther назовава болестта porphyria, а доста по-късно тя получава неговото име (Günther’s disease). През 1926 г. Rasch публикУВ-а случай на порфиринурия с мехури на гърба на ръцете и ясна връзка с алкохолизъм (20), без да го обозначи като porphyria cutanea tarda. Това название за първи път е употребено през 1937 г. от Waldenström, който усилено е проучвал и острата интермитентна порфирия (28). Останалите форми на порфирия са описани доста по-късно.
Слънчевата (соларната) уртикария е дефинирана в началото на XX век и първото съобщение за индуцирана от слънчева светлина уртикария е направено от Merklen в 1904 г., а през следващата година Ayear успява експериментално да провокира заболяването чрез слънчева експозиция. Названието „соларна уртикария” е предложено от Duke в 1923 г., а в 1928 г. Wucherpfennig демонстрира количествено уртикариалния отговор при фототест с покачващи се дози на различни дължини на вълните. В 1942 г. Rajka съобщава за пасивен трансфер с интрадермална инжекция на серум от пациент със соларна уртикария (18).
Историята на локално или системно индуцирана фотосенсибилизация започва по-рано. Първите съобщения се отнасят до провокация при случаен прием на растителни екстракти. През XVI век са били наблюдавани кожни реакции при животни след хранене с елда, последвано от слънчева експозиция. Подобни съобщения правят през XVIII век в Сицилия и Неапол в Италия, където бели овце показват тежки кожни реакции след ядене на кантарион, докато черните овце не пострадват. Между 1908 и 1910 г. Hausmann открива, че хематопорфиринът може да фотосенсибилизира животинската кожа и че отговорните дължини на вълните са в диапазона на зелената видима светлина около 500 nm (по 10).
Първото клинично доказателство за фотосенсибилизиращото действие на някои вещества в комбинация със слънчева експозиция датира от 1912 г., когато Meyer-Betz се самоинжектира с хематопорфирин и се излага на слънце. Така авторът дава дефиниция на фотосенсибилизацията като резултат от съчетаното действие на фотосенсибилизиращо вещество и слънчева светлина и демонстрира липсата на индуцирани явления при самостоятелно въздействие на всеки един от двата провокиращи фактора. Друг пример за системна фотосенсибилизация на човешка кожа е „еозиновата болест”, наблюдавана при болни, лекУВ-ани с орален прием на еозин за епилепсия или други заболявания. През 1939 г. Stephen Epstein показва чрез фотосенсибилизатора сулфаниламид при здрави доброволци съществуването на два механизма: дозо-зависима фототоксична реакция и дозо-независима фотоалергична реакция (по 10).
За първи път в 1913 г. Louis Lewin демонстрира локално предизвикана фотосенсибилзация с каменовъглен катран при работници. В 1916 г. Emanuel Freund съобщава за фототоксични реакции от одеколон, което представлява първото описание на “berloque dermatitis”, като заключава, че най-вероятният фотосенсибилизатор е бергамотовото масло. Първото описание на фитофотодерматити прави в 1920 г. Moritz Oppenheim, а Hans Kuske показва, че фотосенсибилизатори в растенията са фурокомарините и за първи път определя техния спектър на действие между 334 и 366 nm. Кожният фототест (photopatch test) е въведен в 1941 г. от Burckhardt (2).
Видове фотоувеждания на кожата
●Незабавни – настъпващи в относително кратък срок след UV-експозиция на кожата. Тук се включват слънчевото изгаряне, фотосензитивните смущения, нарушението на бариерната функция на кожата, обострянето на фотодерматози, фотоимуносупресията, кожното пигментиране, синтеза на Vitamin D, епидермалната хиперплазия. По отношение на изгарянето и възпалителните явления медиатори са свободни радикали (reactive oxygen species, ROS), транскрибиращи фактори, вазоактивни субстанции, проинфламаторни цитокини и адхезионни молекули. В пигментационните процеси са ангажирани ДНК-възстановяващи фрагменти, α-меланоцит-стимулиращ хормон (α-MSH), азотен оксид, хистамин (9,15,16).
●Кумулативни – развиващи се в дългосрочен план в продължение на години и проявени най-общо като фотостареене на кожата. Дължат се на теломерна сигнализация и ДНК-увреда, клетъчно-мембранна сигнализация с намалена продукция на колаген и увеличеното муразграждане (11,12,13).
Фотодерматозите се подразделят на четири категории (Таблица 1).

Най-често срещаните са полиморфната светлинна ерупция, хроничният актиничен дерматит, соларната уртикария и вторичната фотосенсибилизация при системно лечение (25).
Системна оценка на пациенти с фотодерматози
Системната оценка на пациентите с фоточувствителност е важен стълб в установяването на точната диагноза и е известна като подход на Wilkinson (по Lim). Тя включва задълбочено снета анамнеза, щателен дерматологичен преглед, когато е необходимо – определяне на минималната еритемна доза (MED), фототест (photopatch test) и лабораторни изследвания - като кожна биопсия, ANA, плазмен порфиринов профил.
Анамнеза
Анамнезата със специална насоченост към връзката със слънчева експозиция и особеностите на кожните промени е първата стъпка в комплексния подход към пациентите с въпроси в няколко направления:
- Начало на заболяването (възраст)
- Прилагане на системни или локални фотосенсибилизатори
- Зависимост от сезона
- Интервал между слънчевата експозиция и кожната ерупция
- Продължителност и персистиране на лезиите
- Влияние на стъклата на прозорците (UV-A преминават през стъклата)
- Фамилна история за фотосензитивност
- Системни симптоми
- Анамнеза за съединително-тъканно заболяване.
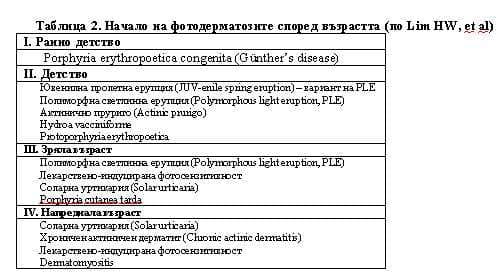
Установяването на възрастта, в която са се появили първите клинични признаци на заболяването, съществено подпомага диагнозата (3). Забележително е, че повечето имунологично медиирани фотодерматози, както и две от кожните порфирии, са с начало предимно в детството или младата възраст. Обратно, хроничният актиничен дерматит, въпреки имунологичната си обусловеност, а също и лекарствено-индуцираната фотосензитивност най-често се проявяват при индивиди над 60-годишна възраст, отразявайки натрупаната експозиция спрямо слънчева светлина и алергени от въздуха (Таблица 2).
Въздействие на фотосенсибилизатори може да бъде разкрито при анамнезата с въпроси за прием не само на предписани медикаменти, но и за безрецептурни препарати или локални средства (4). Най-честите фотосенсибилизатори са дадени на Таблица 3.
Повечето пациенти с фотодерматози получават тежки обостряния през най-слънчевия сезон, въпреки че актиничното пруриго се влошава понякога и през пролетта, есента и дори зимата. Полиморфната светлинна ерупция има по-скоро необичайно протичане с бурно начало в ранния слънчев сезон и по-слаби прояви при засилването на слънчевата радиация. Този феномен на развитие може да се отнесе до имуномодулация с имунологичен толеранс, или т.нар. „ефект на закаляване” на кожата (“hardening effect”). Отделните болестни процеси имат и различия относно скоростта на поява на кожната реакция след слънчева експозиция. При полиморфната светлинна ерупция обривите възникват няколко часа до половин ден след слънчева експозиция, докато при соларната уртикария това време е 5 до 10 минути, а при porphyria cutanea tarda развитието на мехури и ерозии не показва директна връзка със степента на слънчевото въздействие.
Дълго време се приемаше, че стъклата на прозорците са пречка само за UV-B лъчите, но в днешно време се използват много често стъкла за сгради и автомобили, които поглъщат UV-B + UV-A2 (320-340 nm), а дори и такива с филтър за голяма част от UV-A1 (340-400 nm) лъчите. Така само една малка част (около 1%) от UV-спектъра под 380 nm прониква зад стъклата, което осигурява една добра защита на човешката кожа. Очевидно, освен при матови стъкла, видимата светлина успява да премине стъклената преграда (27). От гледище за безопасност предните стъкла на автомобилите са ламинирани и предпазват не само от нараняване при счупването им, но и са добър филтър за UV-A радиацията. Липсата на ламиниране на страничните и задните стъкла обаче крие значителен риск при пътУВ-ане на пациенти с фотодерматози за обостряне на техните заболявания.
Друг аспект на необходимата за фотозависимите дерматози е фамилната информация, която се отнася особено до някои от формите на порфирии, но полиморфната светлинна ерупция и актиничното пруриго също показват в известна степен фамилност (11).

Наличието на определени системни прояви също насочва към съответни диагнози. При данни за остра абдоминална болка, периферна невропатия, парези и фотосензитивност може да се обсъжда porphyria variegata или coproporphyria hereditaria. За отбелязване е, че острата интермитентна порфирия, при която също има абдоминални и неврологични симптоми, не се асоциира с кожни обриви. Анамнеза за феномен на Raynaud, кожни лезии, тромбози, livedo reticularis и мускулна слабост е суспектна за lupus erythematosus или dermatomyositis. При редките фотодерматози с дефектно ДНК нуклеотидно възстановяване е налице мултиорганно засягане.
Фотоагравирани дерматози
Освен вече споменатите съединително-тъканни заболявания (Lupus erythematosus, Dermatomyositis), голяма хетерогенна група болестни процеси имат също общата характеристика да се влошават при слънчева експозиция (6,8,17). Те не са същински фотодерматози, имат различна етиопатогенеза и фотоекзацербацията възниква само при част от боледУВ-ащите от тях индивиди. Тези дерматози са: Acne; Atopic dermatitis; Morbus Darier; Psoriasis; Transient acantholytic dermatosis; Lichen planus actinicus; Porokeratosis superficialis disseminate actinica; Pellagra; Herpes simplex; Pemphigoid bullosus; Erythema multiforme; Pemphigus.
Физикално изследване
Втората част от оценката на пациентите с фотодерматози е щателният физикален дерматологичен преглед със специално внимание към фотоекспонираните (лице, шия, гърба на ръцете, екстензорните повърхности на предмишниците) и фотозащитените (торса, бедрата) участъци. Покритите от облеклото части на кожата обикновено са непроменени, но при силно фотосензитивни индивиди може да се наблюдава и там, макар и по-слабо изразена ерупция. Това се дължи на проникването на UV- радиацията през материята на дрехите, която е степенно пропусклива за лъчите съответно на своята плътност и прозрачност. В САЩ, Австралия и доста европейски страни текстилната индустрия предлага материали за облекло с UV- защита, която е отбелязана като ултравиолетов протективен фактор (UPF).
Морфологията на кожните промени е от съществено значение за определяне на диагнозата (Таблица 6).

Болните с кожни порфирии имат и доста други характерни прояви. При porphyria cutanea tarda се открива периорбитална хипертрихоза, петниста дисхромия и склеродермоидни изменения по откритите идори по закритите кожни участъци. Protoporphyria erythropoetica може да демонстрира екхимози на гърба на ръцете и екстензорните повърхности на предмишниците наред с хронични едри папули (тип „калдъръм”) над интерфалангеалните стави на ръцете, повархностни линеарни или пунктиформени цикатрикси на бузите и носа, радиерни цикатрикси около устните и много суха кожа на фотоекспонираните части. Хелиотропизъм е често наблюдаван при дерматомиозит, а периунгвалните телангиектазии – при еритемен лупус и дерматомиозит.
Минимална еритемна доза (MED) и фототест
Фотоизследванията са интегрална част от оценката на пациентите с фотодерматози (14). Определянето на MED се извършва с шаблон, като незасегната кожа от долната половина на гърба или корема се излага на различни дози UV-B, UV-A и/или видима монохроматична или широкоспектърна радиация. Веднага след облъчването се отчита кожната реакция при соларна уртикария. Повторно отчитане се прави след 24 часа. MED се определя като най-ниската доза на UV-B или UV-A, която е предизвикала най-слабо забележим еритем в цялото въздействано поле. Еритемът се предизвиква от UV-B и UV-A, докато видимата светлина провокира уртикариална реакция при соларната уртикария или по-рядко екземна реакция при тежък хроничен актиничен дерматит. Когато е направено прецизно, изследването в повечето случаи доказва фотосензитивност, макар не и точната диагноза, но определя спектъра на отключващото светлинно въздействие. Индуцирането на лезии чрез последователно (в 3 или 4 дни) облъчване на едно и също кожно поле е познато като фотопровокационен тест и подпомага диагнозата на полиморфната светлинна ерупция или фотосензитивната форма на lupus erythematosus (12). При първото заболяване лезиите обикновено възникват на 3-тия или 4-тия ден след лъчевата експозиция, а при еритемния лупус – дори една-две седмици след облъчването. Фототестът (photo-patch test) се извършва при подозрение за фотоалергичен контактен дерматит. Той включва прилагането на двоен набор от фотоалергени върху незасегната кожа на гърба, след 24 часа единият фотоалергенен набор се облъчва с 10 J/cm2 UV-A или с 50% от MED-A при ниски нива на MED. Сравнителното отчитане на облъчените и необлъчените полета се извършва 48 часа след първоначалната апликация на фотоалергените.

За доуточняване на диагнозата може да се извърши биопсия. При полиморфната светлинна ерупция хистологичната картина отразява стадия на кожните промени, но не е диагностична. Имунофлуоресцентните изследвания не са показателни. При актиничното пруриго имунохистохимично е доказано наличието на Т и В лимфоцити в инфламаторните инфилтрати в кожата, устните и конюнктивата на болните с оформяне на лимфоидни фоликули. Хроничният актиничен дерматит нерядко трудно се диференцира от кожен Т-клетъчен лимфом по хистологични находки, но имунофенотипизирането показва присъствие на CD4+ клетки, за разлика от CD8+ клетките при лимфома. (19) Плазмените и уринарни порфирини са съществено завишени при клинично проявена porphyria cutanea tarda, от които уропорфирин и хептакарбоксил-порфирин се считат за диагностични. Porphyria erythropoetica congenita се диагностицира чрез изследване на порфирини в урината, еритроцитите (уропорфирин I и копропорфирин I), плазмата и фекалиите, а Protoporphyria erythropoetica – с откриване на протопорфирин в еритроцитите. Клиничните диагнози xeroderma pigmentosum и Cockayne syndrome се потвърждават чрез определяне на преживяемостта на клетките след UV- експозиция и капацитета на ДНК-възстановяването в клетъчни тестове. Изследването за антинуклеарни антитела и за тъканно-фиксирани или серумни имуноглобулини могат да отдиференцират същинските фотодерматози от фотоагравирани съединително-тъканни болести или автоимунни булозни дерматози.
Лечение
Лечението на фотодерматозите се определя не само от етиопатогенетичната характеристиката при отделните болестни процеси, но се различава също и във фазите на обостряне, в хроничните фази и в периодите, свободни от клинични прояви. При остри и подостри възпалителни прояви се прилагат локални и системни кортикостероиди, талидомид, антихистамини, Chloroquin (Hydroxychloroquin) и др. При резистентни случаи на хроничен актиничен дерматит се прилагат локални калциневринови инхибитори,перорално cyclosporin, azathioprine, thioguanine, mycophenolate mofetil (5). Eкспериментално локално приложение на ДНК-възстановителни протеини (photolyase, AP lyase/T4 endonuclease) от водорасли и бактерии се съобщава с обещаващи резултати при xeroderma pigmentosum. При порфириите терапевтичното поведение се определя от подвида на заболяването. При високи нива на порфирини метод на избор за лечение представлява флеботомията с масивно кръвопускане, което повлиява върху УВ-еличеното и натоварващо отлагане на желязо в черния дроб, както и избягване употреба на алкохол. Прилагат се също ниски дози (250 mg дневно) Chloroquin.
В подострите и хронични стадии при някои фотодерматози може да се използва фототерапия (UV-A, PUV-A, тесноспектърна UV-B) в последователно понижаващи се дози (1). При възможност се правят също плазмафереза, екстракорпорална фототерапия (фотофореза).
Фотопротекцията е от особено значение за всички фази на всички фотодерматози:
На първо място – избягване на слънчеви експозиции в интервала 10:00-16:00/11:00-17:00 ч.
Защитно облекло (в някои страни с индустриално маркиран UV-защитен фактор), шапки с широки периферии, защитни очила, защитни стъкла на сгради и автомобили.
Достатъчни количества (2 mg/cm2 = 30 ml за цяло тяло) на добри фотопротективни (широк спектър на действие, SPF над 50, UV A - защита, водоустойчивост, фотостабилност на филтрите) и правилна употреба – реапликации на всеки два часа (7).
Особено важна е фотопротекцията на детската кожа, поради нейната незрелост на естествена фотозащита, възможност за засилена резорбция на химични вещества, необходимост от баланс със синтеза на Vitamin D
Индиректна фотопротекция с антиоксиданти за локално и орално приложение (натурални компоненти, аскорбинова киселина, токоферол, зелен чай [епигалокатехин, полифеноли], Polypodium leucotomos extract, препарати за „тен без слънце” (26).
Информация за обществото, стратегия и програми за обучение за предпазване от кожен рак, избягване на злоупотребата със солариуми, промени на околната среда за намаляване на интензивността на слънчевата радиация.
В заключение може да се каже, че фотоиндуцираните дерматози представляват много актуален проблем за медицинската практика и наука и затова трябва да се познават добре от общопрактикуващите лекари.
Използвана литература
1. Breuckmann F, Appelhans C, Altmeyer P. Medium-dose ultraviolet A1 phototherapy in transient acantholytic dermatosis. J Am Acad Dermatol 2005; 52:169–170.
2. Burckhardt W. Untersuchungen u¨ ber die Photoaktivität einiger Sulfanilamide. Dermatologica 1941; 83:63–68.
3. Ensminger PA. Life Under the Sun. Yale University Press, 2001.
4. Ferguson J. Photosensitivity due to drugs. Photoderm Photoimmunol Photomed 2002; 18:262–269.
5. Grone D, Kunz M, Zimmermann R, Gross G. Successful treatment of nodular actinic reticuloid with tacrolimus ointment. Dermatology 2006; 212:377–380.
6. Ichihashi M, Nagai H, Matsunaga K. Sunlight is an important causative factor of recurrent herpes simplex. Cutis 2004; 74:14–18.
7. Kelly DA, Seed PT, Young AR, Walker SL. A commercial sunscreen’s protection against ultraviolet radiation-induced immunosuppression is more than 50% lower than protection against sunburn in humans. J Invest Dermatol 2003; 120:65–71.
8. Kimoto M, Akiyama M, Matsuo I. Darier’s disease restricted to sun-exposed areas. Clin Exp Dermatol 2004; 29:37–39.
9. Lim, HW, Gilchrest BA, Cooper KD, et al. Sunlight, tanning booths, and vitamin D. J Am Acad Dermatol 2005; 52:868–876.
10. Lim HW, Hönigsmann H, Hawk JLM, eds. Photodermatology. Informa Healthcare, New York London, 2007 by Informa Healthcare USA, Inc.
11. McGregor JM, Grabczynska S, Vaughan R, Hawk JL, Lewis CM. Genetic modeling of abnormal photosensitivity in families with polymorphic light eruption and actinic prurigo. J Invest Dermatol 2000; 115:471–476.
12. Meller S, Winterberg F, et al. Ultraviolet radiation-induced injury, chemokines, and leukocyte recruitment: an amplification cycle triggering cutaneous lupus erythematosus. Arthritis Rheum 2005, 52, 1504–1516.
13. Moyal D, Fourtanier A. Acute and chronic effects of UV- on skin: what are they and how to study them? In: Rigel DS, Weiss RA, Lim HW, Dover JS, eds. Photoaging. New York: Marcel Dekker, Inc., 2004:15–32.
14. Ng JCH, Foley PA, Crouch RH, Baker CS. Changes of photosensitivity and action spectrum with time in solar urticaria. Photodermatol Photoimmunol Photomed 2002; 18:191–195.
15. Norval M. Effects of solar radiation on the human immune system. J Photoch Photobio B 2001;63:28–40.
16. Ogawa F, Sander C, Hansel A, et al. The repair enzyme peptide methionine-S-sulfoxide reductase is expressed in human epidermis and upregulated by UV-A radiation. J Invest Dermatol 2006; 126: 1128–1134.
17. Perera GK, Black MM, McGibbon DH. Bullous subacute cutaneous lupus erythematosus. Clin Exp Dermatol 2004; 29:265–267.
18. Rajka E. Passive transfer in light urticaria. J Allergy Clin Immunol 1942; 13:327–345.
19. Ralfkiaer E, Lange Wantzin G, Stein H, et al. Photosensitive dermatitis with actinic reticuloid syndrome: an immunohistological study of the cutaneous infiltrate. Brit J Dermatol 1986; 114:47–56.
20. Rasch C. Some historical and clinical remarks on the effect of light on the skin and skin diseases. Proc R Soc Med 1926; 20:11–20 (after Lim HW, et al).
21. Roelandts R. The diagnosis of photosensitivity. Arch Dermatol 2000; 136:1152–1157.
22. Roelandts R. Bicentenary of the discovery of the ultraviolet rays. Photochem Photoimmunol Photomed 2005: 18:208.
23. Roelandts R. A new light on Niels Finsen, a century after his nobel prize. Photodermatol Photoimmunol Photomed 2005; 21:115–117.
24. Sancar A, Lindsey-Boltz L, Unsal-Kacmaz K, et al. Molecular mechanisms of mammalian DNA repair and the DNA damage checkpoints. Ann Rev Biochem 2004; 73:39–85.
25. Stratigos AJ, Antoniou C, Papathanakou E, et al. Spectrum of idiopathic photodermatosis in a Mediterranean country. Int J Dermatol 2003; 42:449–454.
26. Swindells K, Rhodes LE. Influence of oral antioxidants on ultraviolet radiation-induced skin damage in humans. Photodermatol Photoimmunol Photomed 2004; 20 (6):297–304.
27. Tuchinda C, Srivannaboon S, Lim HW. Photoprotection by window glass, automobile glass and sunglasses. J Am Acad Dermatol 2006; 54:845–854.
28. Waldenström J. Studien über porphyrie. Acta Med Scand 1937; suppl. 82:133(after Lim HW, et al).
Автор на статията:
Доц. Румяна Янкова, д.м.
Ръководител на катедра/клиника по дерматология и венерология - МУ/УМБАЛ „Св.Георги”, Пловдив






Коментари към Фотодерматози - диагностика и лечение