ЕМА одобри лекарство срещу лека форма на болест на Алцхаймер

Акценти
|
Европейската агенция по лекарствата препоръча да се разреши продажбата на медикамента Leqembi (lecanemab) за лечение на леки когнитивни увреждания (отслабване на паметта и затруднен мисловен процес) или лека форма на деменция, причинени от болест на Алцхаймер. Лекарството ще може да се прилага при пациенти без или само с едно копие на гена ApoE4, който се смята за един от основните фактори за развитие на заболяването.
Пациенти с две копия на гена ApoE4 са по-застрашени от мозъчен оток или кръвоизлив
За разлика от хората с две копия на ApoE4, тези, които нямат или имат едно-единствено копие са по-малко застрашени от образна аномалия, свързана с натрупването на амилоидни плаки (ARIA). ARIA е сериозен страничен ефект, който настъпва след прием на Leqembi и се изразява в подуване и кървене в мозъка.
Заключението на Агенцията гласи, че за специфична група пациенти ползите от терапията с Leqembi са по-големи от рисковете.
През юли 2024 г. специалистите не дадоха одобрение за използването му върху всички пациенти в ранна фаза на болест на Алцхаймер.
Lecanemab намалява риска от подуване и кървене в мозъка само при част от пациентите
Ефектът ARIA има две проявления: ARIA-E – събиране на течност в мозъка и ARIA-H – малки кръвоизливи в мозъка. Всеки болен от Алцхаймер е застрашен от подобно усложнение, но приемът на лекарства като Leqembi, насочени към унищожаване на амилоидната плака, увеличава риска.
Европейската агенция по лекарствата (ЕМА) решава да тества медикамента отново, този път върху по-малка група пациенти, като изключва всички, които притежават две копия на гена ApoE4, тъй като са изложени на най-голям риск от ARIA.
Резултатите от анализа показват, че от пациентите, лекувани с Leqembi, оток на мозъка получават 8,9% от тези без или с едно копие на гена ApoE4, в сравнение с 12,6% в общата група пациенти. Кръвоизлив в мозъка получават 12,9% от хората в малката група, докато в общата група делът е 16,9%.
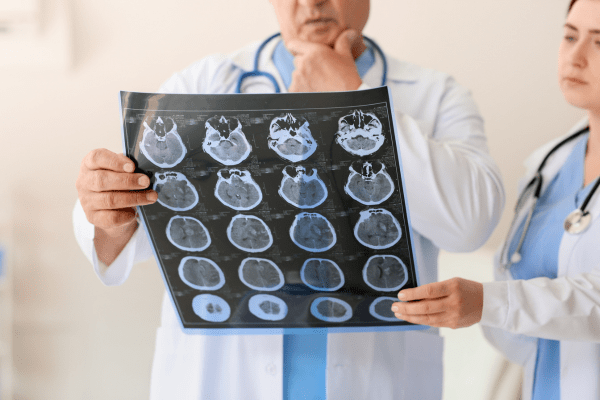
Ползи от лечението с Leqembi
ЕМА провежда изследването върху 1521 души без или с едно копие на ApoE от общо 1795 пациенти. Основният критерий за ефективност е промяната в когнитивните и функционалните симптоми след 18 месеца. За целта учените прилагат скалата за измерване степента на деменция CDR-SB. Тя е 18-точкова, като колкото повече са точките, толкова по-сериозно е увреждането на мозъка.
След 18 месеца учените изчисляват, че влошаването на когнитивните функции при доброволците, лекувани с Leqembi, е по-слабо, отколкото при доброволци, приемали плацебо.
» Лекарството Leqembi доказано забавя хода на болестта на Алцхаймер
Мерки за безопасност при прием на медикамента Leqembi
Представителите на ЕМА заключават, че ползите от лечението с Leqembi са по-големи от рисковете, но единствено при пациенти с леки когнитивни увреждания или лека форма на деменция в резултат на болест на Алцхаймер, които нямат или притежават само едно копие от гена ApoE4.
Все пак учените предупреждават, че трябва да се предприемат всички мерки за минимизиране риска от сериозен оток или кръвоизлив в мозъка (ARIA), както и да се проследят ефектите от лекарството в дългосрочен план.
Програма ще контролира достъпа до лекарството за болест на Алцхаймер
Leqembi ще бъде достъпен чрез специална контролирана програма, която ще гарантира, че медикаментът се приема от пациенти от гореописаната група.
ЯМР изследване с цел предотвратяване на мозъчен оток или кръвоизлив
Преди началото на терапията всеки болен, който отговаря на критериите, ще бъде подложен на ЯМР, за да се изключи мозъчен оток или кръвоизлив. Допълнителни ЯМР изследвания ще бъдат направени преди 5-та, 7-та и 14-та доза на Leqembi. Ако по време на лечението пациентът прояви симптоми на ARIA, като главоболие, объркване, замаяност, гадене и затруднено ходене, също може да се наложи ЯМР.
Ще бъде изготвено ръководство за признаците на ARIA, предназначено за лекарите, както и брошури с важна информация за самите пациенти.
Процедура по одобрение на медикамента
Становището на Европейската агенция за лекарствата е крачка към разрешаване на употребата на Leqembi. То ще бъде изпратено до Европейската комисия, която ще вземе окончателно решение дали лекарството може да се продава в страните членки на ЕС. Ако ЕК разреши продажбата му, всяка държава самостоятелно ще определя цената на медикамента и условията за възстановяване на разходите за неговото закупуване.
Какво представлява медикаментът Leqembi за лечение на пациенти с лека форма на болест на Алцхаймер
Leqembi е с основна съставка lecanemab. Всяка доза се поставя венозно веднъж на две седмици. Активното вещество е моноклонално антитяло, което се закрепва за амилоидния протеин, причиняващ натрупването на амилоидни плаки в мозъка на пациентите с болест на Алцхаймер. По този начин Leqembi намалява количеството на тези плаки в мозъка.
Leqembi recommended for treatment of early Alzheimer’s disease: https://www.ema.europa.eu/en/news/leqembi-recommended-treatment-early-alzheimers-disease
Продукти свързани с НОВИНАТА
ХЕРИЦИУМ таблетки * 120 DXN
НОВИНАТА е свързана към
- Алтернативно лечение на болест на Паркинсон
- Ваксина срещу херпес зостер намалява с 20% риска от деменция
- Грижа за болен с деменция - съвети и препоръки
- Бял трън, Мариански трън, Петнист бял трън
- Алтернативно лечение на деменция
- F03 Деменция, неуточнена
- Деменция и проблеми със съня – каква е връзката между тях
- Как да подсилим паметта си
- Откриха защо хората с фронтотемпорална деменция не изпитват емпатия
- Фелинотерапия или как котките ни лекуват



Коментари към ЕМА одобри лекарство срещу лека форма на болест на Алцхаймер