Имунен отговор при ваксините срещу COVID-19 - сравнение между 11 одобрени ваксини
Една година след началото пандемията COVID-19 продължава да бъде най-горещата тема за обсъждане в целия свят. Новите варианти на вируса, имунитетът срещу него, мерките и желанието час по-скоро да се върнем към нормалния си начин на живот. Ако през март 2020 г. ваксините бяха просто обещание в бъдеще време, то днес разполагаме с 11 ваксини, всяка една от които се прилага в поне една държава, а други повече от двеста кандидат ваксини се намират в различни стадии на предклинични и клинични проучвания. Тук представяме кратка информация за антивирусния имунен отговор и ваксините срещу SARS-CoV-2, които вече са получили или предстои да получат разрешение за употреба.
Антивирусен имунен отговор
Вирусите, които се опитват да завладеят организма ни, се изправят пред впечатляващ набор от препятствия. И никак не им лесно. Така например, когато клетката бъде заразена, едно от нещата, които тя прави, е да „предупреди“ околните клетки за нашественика. Идеята е в отговор на надвисналата опасност клетките да „затворят“ границите си и да преустановят / минимизират дейността на „фабриките си“ за производство на биологично активни молекули. Това не е случайно, защото веднъж попаднал в клетката - гостоприемник, вирусът се възползва от нейната инфраструктура, за да синтезира необходимите за собственото му размножаване вирусни белтъчни молекули и нуклеинови киселини.
При вирусна инфекция нашият организъм най-напред реагира с т.нар. вроден (неспецифичен) имунен отговор. За него може да се говори дълго, но ние ще споменем накратко само някои от участниците. Такива са дефензините – малки молекули, чието име отговаря на природата им (defense – на англ. отбрана). Те се произвеждат от клетки на имунната система, както и от клетки на кожата и лигавиците. Защитната им функция се изразява в способността им да образуват пори в обвивката на патогените, включително вирусите, което води до разрушаването им. Освен това дефензините могат да „слепят“ вирусите, възпрепятствайки по този начин навлизането им в клетките.
Безспорно водеща роля играе интерферонът, който се образува в отговор на вирусната инфекция. Става дума за семейство биологично активни молекули. Първият представител е открит през 1957 г., но са нужни няколко години, за да стане ясно, че т.нар. интерферон тип I е нашият основен защитен механизъм срещу вирусните инфекции. Хората с генетични дефекти, засягащи нормалното образуване и функциониране на интерферона, имат лоша прогноза и умират в млада възраст от вирусни заболявания, които иначе не биха създавали съществени проблеми. Интерферон тип III е с важно значение за т.нар. бариерни функции на лигавиците – своеобразни контролно-пропускателни пунктове, където става първата среща на организма с вирусите, причиняващи респираторни и стомашно-чревни инфекции, например. Интерфероните атакуват вирусите по различен начин, включително като разграждат вирусната РНК, блокират образуването на вирусни белтъци и др.
В хода на съвместната ни еволюция обаче вирусите са изградили и използват различни стратегии, благодарение на които се опитват да излъжат имунната ни система и да избягат от нея. Една от тях е, че потискат секретирането и действието на интерферона. Това с особена сила важи за коронавирусите, които идват от царството на прилепите, какъвто е и SARS-CoV-2. Причината е, че прилепите и коронавирусите отлично са се приспособили едни към други – известно е, че един прилеп може безпроблемно да съжителства едновременно с няколко коронавируси (описани са случаи, при които броят им достига 60). Обясненията на този феномен са комплексни, но едно от тях е, че прилепите непрекъснато произвеждат и поддържат високи нива на интерферон. В отговор на това, коронавирусите са изработили подходи за оцеляване, като потискат активността на интерферона.
След вродения се активира т.нар. адаптивен (специфичен) имунен отговор, който се осъществява с помощта на Б и Т клетките. Нарича се специфичен, защото е насочен срещу конкретен агент. Б клетките са тези, които произвеждат антителата (белтъчни молекули, наречени още имуноглобулини – Иг). Тук е мястото да отбележим, че в отговор на инфекцията с вирус се образува пъстра палитра от антитела. Те се различават по редица параметри – принадлежат на различни класове и субкласове, насочени са срещу различни вирусни структури – белтъци (наричаме ги антигени), функциите им също не се припокриват напълно. Значение за елиминирането на вируса имат неутрализиращите антитела – те се свързват с него и му пречат да инфектира клетките. Антителата са проява на хуморалния имунен отговор.
В случая на SARS-CoV-2 мишена на неутрализиращите антитела е основно (но не единствено) S (Spike) белтъкът, който изгражда шипчетата върху обвивката на вируса. S-белтъкът разпознава входната врата на SARS-CoV-2 върху повърхността на клетките и му помага да навлезе в нея, т.е. да я инфектира. Докато антителата не позволяват на вируса да проникне в клетката, част от Т клетките разпознават вече инфектирани с вируса клетки и ги унищожават. Задачата на други Т клетки е да помагат на В клетките (и не само на тях) да си вършат работата. Т клетките са основните участници в клетъчния имунен отговор.
При първата инфекция, с който и да е вирус, е нужно време за разгръщането на специфичен имунен отговор – първите антитела (ИгМ) се появяват след седмица, нужни са две-три седмици, за да се появи друга група високоефективни антитела (ИгГ). След срещата с вируса в организма ни остават за спомен насочени срещу него антитела както и т.нар. В и Т клетки на паметта, които при следваща среща със същия болестотворен причинител ще го разпознаят, ще се „самосезират“ и ще реагират с по-бърз и мощен имунен отговор, за да предотвратят болестта.
Ваксината имитира именно тази първа инфекция, като осигурява антиген(и), който /които да подготвят имунната система, да я накарат да произведе съответните антитела, Б и Т клетки на паметта, които да реагират бързо при следваща среща с истинския вирус. Ваксините не предотвратяват инфекцията с вируса, но възпрепятстват способността му да ни разболее. А ако все пак това се случи, да не се стига до тежко протичане на болестта.
Това, което знаем до момента е, че предизвиканият от SARS-CoV-2 имунен отговор трае поне 6-8 месеца. Което не означава, че продължава само толкова, просто информацията ни е за такъв период. Данните продължават да се натрупват. Не по-малко интригуващ е въпросът колко дълго ще ни пази ваксината. Най-точният отговор на този въпрос може да даде единствено времето.
Видове ваксини
Ваксинацията е най-успешният медицински подход за профилактика и контрол на инфекциозните заболявания. И макар първата ваксина (тази срещу едрата шарка) да е приложена официално през 1796 г., столетия преди това хората са търсели начини да се предпазят от инвалидизиращи и смъртоносни състояния / заболявания, прилагайки различни, понякога причудливи от съвременна гледна точка подходи. Така например, през 7ми век индийски будисти са приемали малки дози змийска отрова в стремежа си станат неуязвими към ефекта й. В Китай, Индия и Близкия изток са прилагали различни практики за защита от едра шарка - чрез втриване в наранена кожа или в лигавицата на носа на здрави хора на материал от обривите (изсушени корички, съдържимо) на болни от едра шарка (вариола), носене на дрехи на болно дете от здраво и др.
Успешното разработване и използване на ваксини е спасило живота на милиони хора. С тяхна помощ е изкоренена напълно едрата шарка – успех, за който Световната здравна организация съобщава през май 1980 г. Полиомиелитът е на път да я последва. Нещо повече, ваксините имат потенциал да ни помогнат (и вече ни помагат!) в борбата с раковите заболявания, те са и обещаващо средство за елиминиране на алергени и лечение на алергии.
Най-общо, основните типове ваксини, включително срещу COVID-19, са 4 и съдържат:
• Цял вирус – такива са живите (отслабени, атенюирани) и убитите (инактивирани) ваксини;
• Нуклеинова киселина (РНК или ДНК);
• Вирусен вектор;
• Белтък-базирани (субединични ваксини и вирусо - подобни частици).
|
Ваксина |
Предимства |
Недостатъци (Начин за преодоляване) |
|
Отслабени (Атенюирани) живи ваксини |
Голям опит при създаването и използването им Симулират естествената инфекция Ефективен имунен отговор – активират вродения и придобития имунен отговор, хуморалния и клетъчния имунен отговор Активират и т.нар. локален имунен отговор, т.е. този на входната врата на вируса |
По-трудни за съхранение (ниски температури) Възможност (изключително ниска) да възвърнат болестотворността си Неподходящи за хора с имунни дефицити или на имуносупресираща терапия |
|
Инактивирани (Убити) ваксини |
Голям опит при създаването и използването им По-стабилни и по-лесни за съхранение
|
По-кратък имунен отговор – изискват по-високи дози и повече повторения, (обикновено се прилагат с адюванти) |
|
Субединични |
Опит при създаването им По-безопасни – не съдържат цели вируси „По-концентриран“ имунен отговор, т.е. насочен конкретно срещу антигените, които представляват интерес за нас |
По-кратък имунен отговор (прилагат се с адюванти) |
|
Вектор-базирани ваксини |
Стимулират вродения имунен отговор; индуцират Б и Т-клетъчен имунен отговор Няма нужда от адюванти |
Предизвикват имунитет срещу вектора; получаването им включва размножаване на вируса в клетъчни култури |
|
РНК ваксини |
Позволяват бързо производство в голям мащаб По-евтини Стимулират вродения имунен отговор Стимулира Б и Т клетъчния имунен отговор По-безопасни (не се работи с инфекциозен материал, не се очаква интеграция в генома; РНК молекулата се разгражда по естествен път) Производството им не включва размножаване на вируса в кокоши ембриони или клетъчни култури |
Уязвими и с кратък полуживот (Може да се повлияе чрез различни модификации) |
|
ДНК ваксини |
Стимулира вродения имунен отговор Производството им не включва размножаване на вируса в кокоши ембриони или клетъчни култури Стабилни Позволяват бързо производство в голям мащаб Стимулира Б и Т клетъчния имунен отговор По-безопасни – избягва се работа с инфекциозни вирусни частици |
Потенциална възможност за интеграция в човешкия геном |
Целта на всяка ваксина е да представи вирусни антигени на имунната система, за да бъде изграден ефективен имунен отговор, който да не позволи да се разболеем при следваща среща със същия болестотворен причинител. Или, ако това все пак се случи, да не се стигне до тежко протичане на заболяването.
Ваксини, съдържащи цял вирус – вирусът е отслабен или напълно инактивиран чрез различни манипулации, като култивиране в поддържани в лабораторни условия човешки или животински клетки, които не са чувствителни към него или въвеждане в невъзприемчиви животински видове, въздействие с химични съединения (най-често формалдехид) или топлина. Разликата между двата вида ваксини е, че при атенюираните ваксини отслабеният жив вирус се размножава за известно време в организма, осигурявайки по този начин по-продължително взаимодействие с имунната система. Живите ваксини наподобяват естествената инфекция, ангажират вродения и придобития имунен отговор, активират хуморалния и клетъчния имунитет и осигуряват дълготрайна ефективна защита. За да постигнат желаната ефективност, убитите ваксини се прилагат в по-големи дози и повече повторения, често в компанията на адювант – вещество, което стимулира имунния отговор. Предимство на тези ваксини (живи и убити) е и това, че са ни добре познати. Създаването им обаче изисква повече време, за да бъдат получени и обработени по съответния начин огромен брой вируси. Работата с инфекциозен материал, при това в големи количества, крие немалко неудобства и рискове.
Живите ваксини биха могли да причинят проблеми при хора с имунни дефицити или на имуносупресираща терапия, тъй като макар и отслабен, вирусът може да се окаже достатъчно „силен“ за тях. Освен това отслабените вируси може да претърпят мутация, която да възстанови болестотворната им способност. Това е проблем за някои противополиомиелитни ваксини, поради което в редица държави се използва само инактивирана противополиомиелитна ваксина. Разбира се, днес живите ваксини се проектират така, че тези възможности да са минимизирани. Например, отслабен вариант на вирус морбили носи около 50 промени, които не може да преодолее, за да възвърне способността си да предизвиква заболяване. А вирусът в жива ваксина срещу грип е конструиран така, че да може да се размножава само в горните отдели на дихателните пътища и да не е в състояние да „слезе“ към белите дробове и да предизвика пневмония.
Срещу COVID-19 са създадени инактивирани ваксини, някои от които се прилагат в редица държави. До момента няма жива ваксина срещу SARS-CoV-2, която да е в напреднала фаза на клинични проучвания, а броят на разработваните ваксини от този тип е крайно ограничен.
Нуклеинови киселини
• ДНК ваксини – съдържат ДНК, кодираща ваксиналния антиген. В клетката ДНК ще се презапише като информационна РНК (иРНК), която пък на свой ред ще се превърне в белтък. Точно както сме учили в училище. Същият онзи вирусен белтък - антиген, който ни интересува с оглед създаването на имунен отговор.
• РНК ваксини – въвежда се направо иРНК, която ще инструктира клетките как да си произведат вирусния антиген.
Предимството на тези ваксини е, че се произвеждат бързо и лесно, тъй като съдържат само нуклеинова киселина, а не белтък. Неслучайно именно иРНК ваксини бяха първите, които получиха разрешение за спешна употреба срещу COVID-19– ваксините на Pfizer/BioNTech и Moderna. Да, това са първите РНК ваксини, стигнали толкова далеч, сбъдвайки мечтите на поколения изследователи. Но върху създаването на РНК ваксини срещу вируси, причиняващи сериозни заболявания при хора и животни (срещу грип, бяс, ебола и зика вируси) се работи повече от две десетилетия. иРНК технологията успешно се прилага и при разработване на противоракови ваксини, които са изпитани в множество клинични проучвания с обещаващи резултати за увеличаване на периода, в който не е наблюдавана прогресия на онкологичното заболяване.
иРНК ваксините са били тествани най-напред в началото на 1990-те години. Това, което охлажда ентусиазма на учените, е крехкостта на РНК молекулите, които лесно стават жертва на съдържащите се в биологичната среда ензими, а осигуряването на необходимата много ниска температура за съхраняването им определено е предизвикателство. По-късно усилията на изследователите правят възможно оптимизирането на РНК ваксините. Ваксината на CureVac например не изисква замразяване и се съхранява при 2-8оС. Интересът е насочен и към намиране на най-подходящите носители на тези ваксини, способни да запазят целостта на РНК молекулата, да я заведат до правилните клетки и там да я освободят, за да може тя да си изпълни задачите. В ролята на носител при ваксините на Pfizer/BioNTech, Moderna и CureVac влизат липидни наночастици.
Учените виждат в иРНК не само възможност за ваксина, но и за терапевтичен подход. За тази цел се създава иРНК, кодиращи гени за антитяло, което неутрализира съответния болестотвоерeн агент.
Производството на тези ваксини не включва участие на клетъчни култури или необходимост от култивиране на вируса в кокоши ембриони. Това също има своите преимущества, едно от които е, че няма риск от активиране на алергичен пристъп при хора със свръхчувствителност към яйчен белтък (следи от него биха могли да останат в крайните продукт).
Казано накратко, много преди пандемията COVID-19 стана ясно, че иРНК ваксините имат огромен потенциал и предлагат редица предимства пред конвенционалните ваксини, представлявайки обещаваща нова платформа, която е гъвкава и позволява лесно актуализиране както и бързо, мащабно и евтино производство, при това без рисковете, съпътстващи работата с инфекциозен материал. Дадоха заявка, че ще бъдат в състояние да реагират със своевременен отговор при нововъзникващи опустошителни инфекциозни заболявания.
Голям брой предклинични и клинични проучвания са показали, че иРНК ваксините са безопасни и се понасят добре при животински модели и хора.
Вектор-базирани ваксини – използва се вирус-носител (при COVID-19 това са основно аденовируси, но и други вируси – например вирусът на морбили), в който се въвежда генът, кодиращ интересуващия ни белтък - антиген. Вирусът-носител ще инфектира клетката и тя ще произведе съответния антиген. Изборът на вирусни вектори не е лесен, защото
1) Те трябва да са напълно безопасни за хората. Университетът в Оксфорд и фирмата Astra Zeneka използват аденовирус при шимпанзе (ChAdVOx1), който не е патогенен за човека. Освен това, тези вируси – носители допълнително се модифицират, за да бъде напълно гарантирана безопасността им – това става чрез изрязване на техни собствени гени.
2) Друг проблем е способността на вируса-носител да предизвика сам по себе си имунен отговор. Аденовирусите са сред най-честите причинители на инфекции на горните дихателни пътища при хората и огромната част от нас притежават имунитет срещу тях. В резултат, имунната ни система може да „прихване“ вирусите-носители още при първата среща. Затова учените от Университета в Оксфорд и AstraZeneca се насочиха към аденовирус при шимпанзе (с който не сме се срещали и нямаме имунитет).
3) Повечето ваксини обаче се въвеждат в две дози – а между първата и втората има достатъчно време, за да се изгради имунен отговор и срещу вектора. Тази възможност се елиминира чрез генетични манипулации на вектора-носител, от който се изрязват гени, чиито продукти са отговорни за предизвикването на имунен отговор. Руската ваксина „Спутник V“ използва друга стратегия – при нея за първата и втората доза на ваксината се използват различни аденовирусни вектори (Ad5 и Ad26).
Различните популации хора имат изразен в различна степен имунитет към отделните човешки аденовируси, различните възрастови групи също. Освен това имунитетът срещу аденовирусите трае дълги години. Неутрализиращи антитела към Ad26 се откриват при 10-20% от жителите на Европа и САЩ, но при 80% до 90% от хората, населяващи Субсахарска Африка. Безспорно, значение има и количеството на тези антитела. Прилагането на съдържащи Ad26 ваксини срещу ХИВ и Ебола при повече от 80 000 души в Субсахарска Африка показва, че аденовирусният вектор не става жертва на предварително съществуващите антитела срещу него. Най-вероятно, защото нивата им са ниски.
За разлика от живата ваксина, аденовирусният вектор не се размножава, поради което е необходимо във всяка доза ваксина да бъде включен голям брой вирусни вектори – стотици и хиляди пъти повече в сравнение с живата ваксина.
Едно от големите предимства на вектор-базираните ваксини е, че те стимулират имунния отговор без помощта на адювант, който може да добави допълнителна сложност към формулирането и съхраняването на ваксините. Друго предимство е, че веднъж създаден, един аденовирусен вектор може да се използва в различни ваксини – заменя се само генетичната информация в него (т.е. гена за интересуващия ни антиген).
Вектор базирани са ваксините срещу Ебола, които бяха одобрени през ноември 2019 и декември 2020 г. Те съдържат вектори, създадени на основата на Ad26 и вируса на везикуларния стоматит. От ваксините срещу COVID-19 такива са тези на Университета в Оксфорд / Astra Zeneca, Johnson & Johnson, както и руската ваксина „Спутник V“.
Ваксина на Университета в Оксфорд и Astra Zeneca
Ваксината на Университета в Оксфорд и компанията Astra Zeneca представлява вектор от аденовирус при шимпанзе (ChAdVOx1), съдържащ гена за S-белтъка на SARS-CoV-2. Прилага се в две дози. Докато СЗО я препоръча при всички на и над 18 годишна възраст, някои държави (поне временно) насочиха приложението й към хора до 65 г. и дори до 55 г. Защо се случи така? Причината е, че в клиничните проучвания, чиито резултати доведоха до разрешаването й за употреба от Европейската агенция по лекарствата, са обхванати основно доброволци на възраст от 18 до 55 години. Броят на участниците над 65 години е бил нисък, а броят на случаите на COVID-19 (общо в двете групи – на ваксинираните и получилите фиктивна ваксина – т.нар. плацебо) – нищожен (2 случая при 660 участника). Това не е позволило да бъдат направени статистически значими изводи за ефективността й, тъй като за анализа са нужни определен брой минимални случаи. В същото време от Компанията съобщават, че проследяването на имунния отговор при ваксинираните възрастни хора обещава те също да са надеждно защитени. В ход са клинични проучвания при по-възрастни хора, чиито резултати се очакват.
Две скорошни статии в списание “The Lancet” (от 27 февруари 2021 г. и 06.03.2021 г.) представят актуализирани данни за ефективността на ваксината след представянето на междинните данни, публикувани отново в “The Lancet” на 08.12.2020 г. Включени са данни от 4 проучвания в 3 държави: фаза 1/ 2 във Великобритания, фаза 2/ 3 във Великобритания, фаза 3 в Бразилия и фаза 1/ 2 в Южна Африка, с общо 24 422 участника, от които 17 178 са включени в представения анализ на ефикасността. Проучванията са проведени между 23 април 2020 г. и 06.12.2020 г.
Установено е, че единичната доза осигурява ефективност от 76% пред първите 9- дни след ваксинацията. Ако поставянето на двете дози се осъществи с интервал от 12 седмици или повече, ефикасността на ваксината е 81.3%. При интервал по-кратък от 6 седмици е 55%. Подобно усилване на имунния отговор с удължаване на интервала между първата и втората доза на ваксините е наблюдавано и при други ваксини, например срещу грип, ебола, малария. Проучвания относно влиянието на ваксината върху предаването на вируса не са включени в публикацията. Авторите обаче споменават, че според резултатите от осъществените във Великобритания изследвания в тази посока, ваксината оказва такъв ефект.
Най-честите описани странични ефекти при прилагането на ваксината на AstraZeneca (при повече от 1 на 10 ваксинирани) са реакция на мястото на инжектирането (чувствителност, болка, затопляне, сърбеж), втрисане, гадене, умора, болки ставите и мускулите. Честите симптоми (при до 1 на 10 ваксинирани) включват подуване, зачервяване или бучка на мястото на инжектиране, висока температура, гадене (повръщане), диария грипоподобни симптоми, (висока температура, възпалено гърло, хрема, кашлица и студени тръпки). По-редките странични ефекти (при до 1 на 100 ваксинирани) се изразяват в чувство на замаяност, намален апетит, болки в коремната област, увеличени лимфни възли, прекомерно изпотяване, сърбеж по кожата или обрив (https://www.gov.uk/government/publications/regulatory-approval-of-covid-19-vaccine-astrazeneca/information-for-uk-recipients-on-covid-19-vaccine-astrazeneca). Продължителността на страничните ефекти (както тук, така и при останалите ваксини) е кратка (до 2-3 дена), като се проявяват един или повече от описаните симптоми.
На 1 март 2021 г. ВВС съобщи, че при проучване върху пациенти в две болници в Бристол е намерено, че и двете ваксини – Pfizer/BioNTech и Oxford/AstraZeneca предотвратяват с 80% приема в болница на хора над 80-годишна възраст. Малко по-късно това доведе до промяна на позицията на Франция във връзка с това за кои групи хора е подходяща ваксината на Oxford/AstraZeneca. Това беше обявено от здравния министъра на Франция Оливие Веран в изявление по телевизия France 2: „Всеки на възраст над 50 години, който има съпътстващи заболявания, може да получи ваксината AstraZeneca, включително тези между 65 и 74 години“.
Междувременно малко клинично проучване в Южна Африка породи съмнение в способността на ваксината да се справи с разпространения там Южноафрикански вариант. От АstraZeneca заявиха, че работят върху актуализация на ваксината и са нужни от 6 до 9 месеца, за да стане тя достъпна за широко приложение.
Ваксина на Johnson & Johnson
Ваксината съдържа човешки аденовирусен вектор (Ad26), в който е включен генът за S-белтъка на SARS-CoV-2. Прилага се в една доза, което е голямо предимство в условията на пандемия. През юли 2020 г. от Компанията съобщиха, че ваксината защитава макаци от SARS-CoV-2, а през септември 2020 г. – че предотвратяват тежко заболяване при хамстери. По време на клиничните изпитвания, обхванали 43783 доброволци, тази ваксина е влязла в директен сблъсък с новите варианти на вируса, показвайки ефективност от 72% (в САЩ), 64% (в Южна Африка) и 68% (в Бразилия). Способността й да предотврати тежките / критичните случаи на COVID-19 е 85.9% (в САЩ), 81.7% (в Южна Африка) и 87.6% (в Бразилия). Регистрирани са три смъртни случая свързани с COVID-19, като всички те са в групата, приемала фиктивна ваксина (плацебо). Ваксината може да се съхранява 3 месеца в обикновен хладилник (2-8оС) и 3 години при температура -20оС, което ще улесни разпространението й в различни райони.
Страничните ефекти на ваксината се изразяват в реакция на мястото на инжектирането (болка, зачервяване, подуване), главоболие, силна умора, мускулни болки, гадене и втрисане (https://www.jnj.com/johnson-johnson-covid-19-vaccine-authorized-by-u-s-fda-for-emergency-usefirst-single-shot-vaccine-in-fight-against-global-pandemic).
Бахрейн е първата държава, която разрешава ваксината за спешна употреба. На 27 февруари 2021 г. ваксината на Johnson & Johnson получи разрешение за спешна употреба от Агенцията за контрол върху храни и лекарства в САЩ (FDA) и е в процес на разглеждане от Европейската агенция по лекарствата (ЕМА). Решението на ЕМА се очаква на 11 март 2021 г.
На 16 ноември 2020 г. започна второ клинично проучване, целта е да се изпита ефекта на две дози. Резултатите се очакват в края на 2021 г. През февруари 2021 г. компанията стартира клинично проучване при бременни жени, през март обяви, че скоро ще започне изпитвания и при деца. В интервю от 4 март 2021 г. главният изпълнителен директор заяви, че ваксината за деца се очаква да стане достъпна до септември 2021 г. От 2 март от компанията “Merck” обявиха, че ще помагат на Johnson & Johnson в производството на ваксината срещу COVID-19
„Спутник V“
Руската ваксина „Спутник V“ е създадена от Националния изследователски център по епидемиология и микробиология „Н.Ф. Гамалея“ в Москва, Русия. Ваксината се прилага в две дози – първата чрез Ad26, а втората с Ad5. И двата вектора съдържат гена за S-белтъка на SARS-CoV-2.
На 20 февруари 2021 г. в списание “The Lancet” бяха публикувани резултати от клинично проучване фаза 3, проведено в периода 7 септември 2020 – 24 ноември 2020 г. То обхваща 21 977 възрастни (16501 ваксинирани и 5476, приемали фиктивна ваксина - плацебо), разпределени в следните групи: 18 – 30 г.; 31- 40 г.; 41 – 50 г.; 51 – 60 г. и над 60 годишна възраст. Съотношението между жените и мъжете е 39% : 61%. От 21 ден след получаването на първата доза на ваксината (т.е. от деня, в който е поставена втората доза) са регистрирани общо 78 случая на COVID-19, от които 16 в групата на ваксинираните (0.1%) и 62 в групата, приемала фиктивната ваксина – плацебо (1.3%). Ефективността е 91.6%. Умерените и тежките случаи на COVID-19 са 20, от които нито един не е бил в групата на ваксинираните.
В проучването са включени хора на и над 18 години, които отговарят на редица изисквания, сред които: да имат отрицателни тестове за ХИВ, хепатит В вирус, хепатит С вирус и сифилис; да имат отрицателен PCR тест за SARS-CoV-2, както и отсъствие на антитела срещу него; да не са боледували от COVID-19; да не са били в контакт с инфектирани със SARS-CoV-2 пред последните 14 дена; да не са имали остро респираторно или инфекциозно заболяване през последните две седмици; в миналото не са показали сериозни реакции предизвикани от ваксини; отсъствие на бременност (при жените в детеродна възраст). Сред критериите, които не позволяват включване в проучването са: поставяне на ваксина (каквато и да е) през последните 30 дена, пристрастяване към алкохол или наркотици, през изминалата година да са страдали от остър коронарен синдром или да са получили сърдечен удар. В проучването не са били включени бременни и кърмещи жени. Страничните ефекти на „Спутник V“ се изразяват в реакция на мястото на инжектирането, слабост, главоболие, грипоподобни симптоми. По време на проучването са регистрирани 4 смъртни случая (3 при ваксинираните и 1 в групата плацебо), но нито един от тях не е свързан с ваксината. Ваксината предизвиква хуморален и клетъчен имунен отговор във всички възрастови групи. Ефикасността на ваксината при хората над 60 г. не се различава съществено от тази при 18-60 годишните.
След Русия, Беларус е първата държава, която регистрира ваксината, това се случи на 22 декември 2020 г. „Спутник V“ е разрешена за спешна употреба в редица държави, след които Аржентина, Бахрейн, Боливия, Виетнам, Египет, Иран, Ирак, Обединени арабски емирства и Унгария.
В момента текат клинични проучвания върху комбинираното приложение на една доза „Спутник V“ (Ad26) и една доза от ваксината на AstraZeneca. На 4 март 2021 г. Европейската агенция по лекарствата (ЕМА) започна текущ преглед на резултатите от клиничните проучвания на ваксината „Спутник V“.
Субединичните белтък базирани ваксини съдържат (фрагменти от) вирусни белтъци. Повечето кандидат-ваксини срещу COVID-19 са фокусирани върху белтъка на шипчето (S-белтъка), особено върху онази част от него, която директно се свързва с входната му врата върху клетката (т.нар. рецептор-свързващ участък). Обикновено този тип ваксини се прилагат с адюванти. Те изискват прилагане на повече дози, за да се осигури продължителен имунен отговор.
Вирусоподобните частици най-често представляват обвивката на вируса, върху която (както е и при ваксината срещу COVID-19) са разположени белтъците, срещу които се образуват неутрализиращите антитела. Главното предизвикателство пред този вид ваксини са затрудненията с производството им. От фирмата Medicago, чиято ваксина срещу SARS-C0V-2 е в трета фаза на клинични изпитвания, виждат решението на този проблем в използването на растения като миниатюрни биофабрики за синтез на интересуващите ни белтъци (антигени).
Към белтък-базираните ваксини срещу COVID-19 спада и разработената от компанията Novavax (NVX-CoV2372). За създаването й специалистите са въвели гена за S-белтъка в бакуловирус (вирус, който инфектира насекоми), с който след това са заразили клетки от насекоми (молци). Инфектираните клетки произвеждат S-белтъците на SARS-CoV-2, които спонтанно се съединяват, за да образуват шипчетата. Оформят се наночастици, наподобяващи структурата на вируса, както и способността му да предизвика имунен отговор, но не и заболяване. Подобен подход е приложен и за получаване на някои ваксини срещу грип и човешки папиломен вирус (HPV), които вече са лицензирани.
Ваксината срещу COVID-19, разработена и тествана от Novavax, е приета за текущ преглед от Европейската агенция по лекарствата (EMA).
Текущият преглед е регулаторен инструмент, който EMA използва, за да ускори оценката на обещаващ медицински продукт (лекарство, ваксина) по време на извънредна ситуация в областта на общественото здраве. Обикновено всички данни за ефективността, безопасността и качеството на лекарството или ваксината както и всички необходими документи трябва да бъдат готови в началото на оценката в официално заявление за разрешение за употреба. В случай на текущ / непрекъснат преглед, Комитетът по лекарствата за приложение в хуманната медицина (CHMP) на EMA преглежда данните от текущи проучвания, веднага щом те станат достъпни. След като Комитетът реши, че са налице достатъчно данни, компанията-производител може да подаде официално заявление. По този начин, чрез преглед на данните, веднага щом те станат достъпни, когато те станат достъпни, ЕМА може да стигне до становище относно разрешението на медицинския продукт по-рано.
Ваксината на Novavax e във фаза 3 на клинични изпитвания в Обединеното кралство и САЩ. В съобщение за медиите от 28 януари 2021, Компанията обяви междинни резултати от проучвания във Великобритания (фаза 3, с 15 000 доброволци) и Южна Африка (Фаза 2b, с 4 400 участника). Те показват, че ефективността на ваксината в Обединеното кралство е 89.3% в среда, в която над 50% от случаите на COVID-19 са причинени от Британския вариант (B.1.1.7). Eфективността спрямо оригиналния вариант надхвърля 95%. Ефективността на ваксината в Южна Африка е 60% - тук, според прессъобщението, приблизително 90% от инфекциите със SARS-CoV-2 сe дължат на Южноафриканския вариант (B.1.351). 6% от участниците в проучването в Южна Африка са ХИВ-позитивни – ефективността на ваксината при тях е 49.4%
Кратка информация за ваксините срещу COVID-19 – разрешени за употреба или в напреднала фаза на клинични проучвания
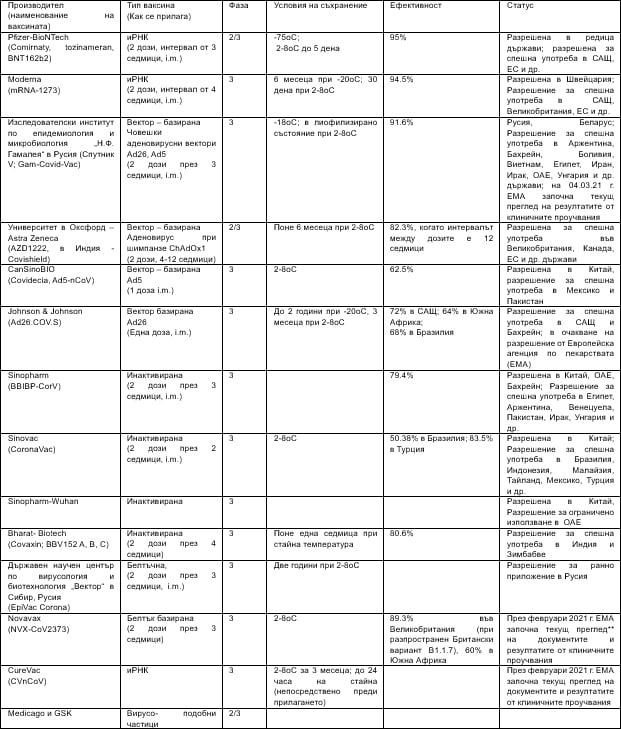
(вижте таблицата в по-добра резолюция)
*Ранно приложение или ограничено приложение – когато приложението на ваксината е започнало преди да бъдат оповестени подробни данни от изпитването във Фаза 3.
**Текущият преглед е регулаторен инструмент, който EMA използва, за да ускори оценката на обещаващ медицински продукт (лекарство, ваксина) по време на извънредна ситуация в областта на общественото здраве. Обикновено всички данни за ефективността, безопасността и качеството на лекарството или ваксината както и всички необходими документи трябва да бъдат готови в началото на оценката в официално заявление за разрешение за употреба. В случай на непрекъснат преглед, Комитетът по лекарствата за приложение в хуманната медицина (CHMP) на EMA преглежда данните от текущи проучвания, когато те станат достъпни. След като Комитетът реши, че са налице достатъчно данни, компанията-производител може да подаде официално заявление. По този начин, чрез преглед на данните, веднага щом те станат достъпни, когато те станат достъпни, ЕМА може да стигне до становище относно разрешението на медицинския продукт по-рано.
-
 Ваксините срещу COVID-19: най-често задаваните въпроси - проф. Радостина Александрова - част 2
Ваксините срещу COVID-19: най-често задаваните въпроси - проф. Радостина Александрова - част 2
-
 За вирусите, ваксините, доверието в науката и куража да продължим напред - проф. Радостина Александрова - част 1
За вирусите, ваксините, доверието в науката и куража да продължим напред - проф. Радостина Александрова - част 1
-
 Защо ваксините срещу COVID-19 бяха създадени толкова бързо
Защо ваксините срещу COVID-19 бяха създадени толкова бързо
-
 За ваксините и опасенията: думата има науката
За ваксините и опасенията: думата има науката
ПУБЛИКАЦИЯТА е свързана към
- Ваксините срещу COVID-19: най-често задаваните въпроси - проф. Радостина Александрова - част 2
- Назалните ваксини срещу COVID-19 помагат на имунната система да се подготви за инфекцията
- За вирусите, ваксините, доверието в науката и куража да продължим напред - проф. Радостина Александрова - част 1
- Ролята на клетките от човешки ембриони при създаването на ваксини
- Nimbus – „облачният“ вирус, който отново разбуни духовете
- Д-р Лиана Уен: Смъртта на ваксинирани срещу COVID-19 не означава, че ваксините не са ефективни
- Четири фактора, които увеличават риска от заразяване с коронавирус при ваксинирани хора
- В САЩ разрешиха бустерна доза от ваксината срещу COVID-19 на Pfizer за деца от 5 до 11 години
- Ваксинацията срещу COVID-19 – тука има, тука няма
- Гръцки медици стачкуват против задължителната ваксинация срещу COVID-19
Коментари към Имунен отговор при ваксините срещу COVID-19 - сравнение между 11 одобрени ваксини