За вирусите, ваксините, доверието в науката и куража да продължим напред - проф. Радостина Александрова - част 1
На 11 декември 2020 г. ваксината срещу COVID-19 на Pfizer/BioNTech получи разрешение за спешна употреба при хора на и над 16 години от Американската агенция за контрол върху храни и лекарства (Food and Drug Administration - FDA). На 21 декември 2020 г. Европейската агенция по лекарствата (European Medicines Agency – ЕМА) също даде зелена светлина на този дългоочакван продукт. Ваксинирането е в ход, а заедно с него расте и надеждата, че скоро ще излезем от кошмара на пандемията, в който светът живее вече десети месец. България също получи първите дози ваксини и започна да ги прилага на 27.12.2020 г.
Днес ваксините са сред най-горещите новини. Препредават ги телевизии, радия, вестници… Медиите се надпреварват да търсят и предлагат информация. Социалните мрежи прегряват от коментари.
Най-хубавото в случая е, че продуктът на Pfizer/BioNTech далеч не е единствен. Буквално по петите го следва ваксината на Moderna (получила разрешение за спешна употреба от FDA на 18.12.2020 г.), голяма известност придоби руската ваксина „Спутник V“. Усилено се работи върху повече от 233 проекта за ваксини, от които над 61 са в клинични изпитвания при хора, а повече от 10 са във Фаза 3.
Освен с благодарност и надежда, те се посрещат и с немалко притеснения от най-различен характер.
Нека заедно се разходим в света на ваксините и опитаме да намерим отговорите на поне част от въпросите, които ни вълнуват. Истината е най-добрата политика и единствено знанието може да ни помогне да вземем разумни решения.
Ваксините – такива, каквито (не) ги познаваме
Видове ваксини
Познати са различни видове ваксини – всеки един от тях има своите предимства и недостатъци. Нека разгледаме последователно основните подходи за получаването им:
- Отслабени (атенюирани) живи ваксини
Отслабени (атенюирани) живи ваксини- както показва наименованието, в този случай вирусът (нека го наречем ваксинален виурс) е отслабен до степен да не може да предизвика заболяване, но е запазил способността си да стимулира образуване на имунен отговор. Как се постига това? Една от възможностите е изходният вирус да бъде култивиран в неподходящи/неблагоприятни за него условия. Например, вирус при един вид животни да се култивира в клетки от друг вид. Така са получени някои от най-старите познати ваксини, сред които е тази срещу беса. Създадена е от Луи Пастьор в далечната 1884 г. При съвременната жива ваксина срещу грип подходът е друг. В този случай вирусни гени, кодиращи белтъци, срещу които е насочен нашият имунен отговор (това са гликопротеините хемаглутинин и невраминидаза), се въвеждат в приспособен към ниски температури „отслабен“ (неспособен да предизвика заболяване) грипен вирус-носител. Той е изменен така, че може да се размножава само в горните отдели на дихателната система, където температурата не надвишава 33оС поради директния контакт с околната среда. Ваксината представлява интраназален спрей за впръскване и по този начин имитира естествения път, по който става заразяването с грипния вирус.
Това е и едно от предимствата на живите ваксини – ваксиналният вирус прониква в нас през официалния вход, който използва и истинският вирус в реални условия. Това е важно, защото по този начин се стимулира имунната система не само в целия организъм, но и т.нар. местен имунен отговор – първият, който ще влезе в схватка с вируса. Ефективността на живите ваксини е голяма и по още една причина – ваксиналният вирус се размножава в клетките за известно време (без да ни разболява). Така, благодарение на произведените дъщерни ваксинални вируси, имунната система ще бъде провокирана за по-дълъг период от време. Ето защо тези ваксини обикновено се прилагат еднократно.
Разбира се, медалът винаги има две страни. Живите ваксини са по-трудни за съхранение, тъй като изискват ниски температури. Макар и отслабен, ваксиналният вирус може да е в състояние да предизвика заболяване при хора с имунни дефицити, както и при такива на имуносупресираща терапия. Отслабените живи ваксини не са подходящи и за бременни жени поради опасност от увреждане на плода. Макар и изключително нисък, съществува риск отслабеният вирус да възвърне своята способност да предизвиква заболяване (т.е. вирулентността си). Такива случаи са наблюдавани при отслабената жива ваксина срещу полиомиелит, в резултат на което се развива т.нар. ваксино-индуциран полиомиелит. Честотата на това нежелано събитие е 1 на 2.5 – 3 милиона ваксинирани и обикновено се регистрира при хора с имунен дефицит (инфекция с ХИВ).
- Убити (инактивирани) ваксини
Убити (инактивирани) ваксини – вирусът е напълно инактивиран (чрез топлинна обработка и/или въздействие с химични вещества). Разликата с живите ваксини е, че в този случай ваксиналният вирус не се размножава, бързо се изчиства от организма и за по-ограничен период от време провокира имунната система. Затова създаденият от тях имунитет е по-кратък и успешното ваксиниране обикновено изисква сравнително големи дози и повече апликации. Много често се прилагат с т.нар. адюванти – вещества, които усилват имунния отговор. В същото време убитите ваксини са по-стабилни, по-лесно се произвеждат и съхраняват. От ваксините срещу COVID-19 такива са някои от разработваните в Китай и Индия.
- Субединични ваксини
При субединичните ваксини не се въвежда цял вирус, а само част от него. Целта е да бъде изключен напълно рискът от възникване на заболяване, както и това имунната система да не се „разсейва“, реагирайки срещу различни участъци от вируса, а да се концентрира върху определени мишени в него. Това, последното, също е важно, защото при естествена вирусна инфекция неутрализиращи антитела (това са антителата, които разпознават вируса, свързват се с него и не му позволяват да инфектира клетката – неутрализират го) се образуват срещу отделни вирусни белтъци (наричат се антигени), т.е. няма нужда да се хаби излишен ресурс. Субединични са някои от добре познатите ни ваксини срещу грипния вирус. Субединична е и подготвяната от Novavax ваксина срещу SARS-CoV-2, която ще се прилага в две дози заедно с адювант.
Тези ваксини често се създават чрез т.нар. рекомбинантна технология. При нея култивирани в лабораторни условия клетки биват инструктирани какъв точно белтък искаме да произведат. Впоследствие той се изолира, пречиства и се използва като ваксина, най-често заедно с адювант. Описаните по-долу векторни ваксини, при които генът за шипчето на SARS-CoV-2 e въведен в безопасни за човека аденовируси, също са вид рекомбинантна ваксина.
Тъй като субединичните ваксини се приготвят от отделни компоненти на вируса, страничните реакции при тях са по-малко.
- РНК ваксини.
За пръв път РНК е била използвана за терапевтични цели при лабораторни животни през 1990 г. Тези ваксини се произвеждат по-бързо и са по-евтини, което ги прави изключително подходящи за извънредни ситуации като пандемията, в която се намираме в момента. Докато ДНК молекулите са стабилни и, както знаем и от криминалните филми, могат да се запазят дълго време и то при не съвсем благоприятни условия, РНК молекулите са доста уязвими и имат съвсем кратък живот.
В основата на тези ваксини стои т.нар. информационна РНК (иРНК, messenger RNA – mRNA). Нейната роля в организма е да служи като посредник между геномната ДНК (намира се в ядрото на клетката), в която е записана информация за състава/строежа на белтъците, и разположените в цитоплазмата фабрики (нар. се рибозоми) за тяхното производство. Образно казано, иРНК ваксината срещу COVID-19 носи инструкции за синтезиране на белтък на вируса SARS-CoV-2 (да го наречем ваксинален белтък или антиген). Следвайки получените указания, нашите клетки ще го произведат, имунната система ще го разпознае като чужд и ще изгради имунен отговор срещу него – както чрез антитела (хуморален имунен отговор), така и клетъчен имунен отговор. Въпросният белтък не е избран произволно. Тук, както и при останалите разработвани ваксини срещу COVID-19, целта е създаване на имунен отговор срещу т.нар. „шипче“ (Spike или S белтък). Това е белтък от повърхността на коронавируса, който разпознава входната врата за SARS-CoV-2 върху клетката (т.нар. рецептор) и му помага да навлезе в нея, т.е. да я инфектира. Затова имунната ни система реагира срещу него чрез образуване на неутрализиращи антитела и изграждане на клетъчен имунен отговор. На този принцип са ваксините, създадени от Pfizer/BioNTech и Moderna. И при двете ваксиналната РНК е поставена в специална обвивка - носител (наночастици), която я предпазва от разграждане и осигурява безпрепятственото й достигане до крайния адрес в организма – нашите клетки.
Предимство на РНК ваксините е това, че иРНК няма да се включи в човешкия геном. Процесите са пространствено разделени – ДНК е в ядрото, а задачата на иРНК е да презапише информация за съответния ген от нея и да излезе в цитоплазмата, за да инструктира рибозомите какъв белтък трябва да произведат. По обясними причини, в случая на ваксиналната иРНК дори няма да й се налага да влиза в ядрото, тъй като необходимата информация е записана в нея предварително. Движението на генетичната информация от ДНК към иРНК е основен закон в природата. Обръщането му е равнозначно на това реката да смени посоката на течението си. Освен това, както вече пояснихме, животът на РНК е твърде кратък. Да, разбира се, има изключения. Това са ретровирусите (какъвто е ХИВ), чийто РНК геном се превръща в ДНК молекула (това става с помощта на ензим, който самите вируси си носят) и така се вгражда в нашата ДНК. Което, обаче, е един съвсем друг случай.
- Ваксини, основани на вирусни вектори
Наричат се така (векторни), защото ваксината се доставя там, където трябва. Срещу COVID-19 се използват аденовируси, в които е въведена ДНК, кодираща S-белтъка на SARS-CoV-2 (вече пояснихме защо). Оттук нататък се задвижва класическият ход на системата ДНК-иРНК-белтък.
Изборът на специалистите неслучайно се е спрял на аденовирусите, защото те са сред основните причинители на инфекции на горните дихателни пътища. С тяхна помощ S белтъкът ще попадне точно там, където и при естествена инфекция със SARS-CoV-2. Което е добре дошло за създаването на имунния отговор;
Избраните за вектори аденовируси не са патогенни за човека. За целта се използват например аденовируси при шимпанзе (такава е ваксината на Университета в Оксфорд и Astra Zeneca), който не е болестотворен за хората. Освен това, аденовирусният вектор е допълнително модифициран, за да е напълно безопасен за нас;
Насочването на учените към животински аденовируси не е случайно и по още една причина. Всеки един от нас многократно се е заразявал с човешки аденовируси и голяма част от нас вече имат имунитет срещу тях. Затова, ако подобен аденовирус бъде използван като вектор, имунната ни система може да го унищожи преди той да е изпълнил задачата си да ни ваксинира. За да бъдем напълно изчерпателни, трябва да споменем и това, че въведен в нас с първата доза на ваксината, животинският вирус може да предизвика имунен отговор срещу самия себе си, което да отслаби ефективността на втората доза на ваксината. Намаляването на този риск се постига чрез модифициране на аденовирусния вектор;
Аденовирусите не се интегрират в човешкия геном. Най-доброто доказателство за това е, че такова нещо не ни се е случило, макар да сме преминали през не една и две инфекции с тях. И още – подобни аденовирусни вектори се използват широко в генната терапия на ракови заболявания – почти 20 години те са най-често използваните вирусни вектори за тази цел, наблюдения при тях има при голям брой проучвания при хора.
И, като така и така сме се заговорили за този тип ваксини, нека поясним още две понятия:
- Реплициращите се векторни ваксини са тези, при които използваният като вектор вирус се размножава в инфектираните клетки, образува потомство, което ще инфектира и други клетки. По този начин се осигурява по-продължително производство на ваксиналния белтък (антиген), който е кодиран в него. А това е от полза за имунния отговор. В това отношение те наподобяват отслабените живи ваксини. За разлика от това, при нереплициращите се векторни ваксини, вирусът не се размножава, което означава, че интересуващият ни ваксинален белтък (антиген) ще бъде създаван само при първото навлизане вируса-вектор в клетката. Ваксината, произведена от Университета в Оксфорд и компанията AstraZeneca е именно от този тип.
- ДНК ваксини
При тях в организма се въвежда ДНК, кодираща белтъка, срещу който искаме да създадем имунен отговор. Върху този вид ваксини се работи усилено вече две десетилетия. В момента, само в САЩ се провеждат над 500 клинични проучвания с ДНК ваксини при ракови и инфекциозни заболявания. Предимство е температурната стабилност на ДНК ваксините, възможността за бързото им и сравнително лесно получаване, достъпната цена. При тях, както и при РНК ваксините, се избягва работата с инфекциозни вирусни частици.
Това, което трябва да се има предвид, е потенциалната възможност ваксината да предизвика образуване на антитела срещу себе си, както и евентуално включване (интеграция) на ваксиналната ДНК в генома на гостоприемника – както в телесните, така и половите клетки, водейки до промяна в регулацията на генната активност и мутации. Учените не спират да търсят отговор на въпроса доколко основателни са тези опасения. Проведените изследвания показват, че честотата на подобна интеграция е доста по-ниска от тази на спонтанно възникващите мутации. По-голямата част от мускулно въведената чужда ДНК остава на мястото на инжектирането, а една съвсем незначителна фракция се открива в други органи, включително в половите жлези, но не се интегрира в генома. Независимо от това, гореспоменатите, както и допълнителни съображения свързани с безопасността на ДНК ваксините (например взаимоотношенията им с нашия микробиом), не излизат от фокуса на внимание на специалистите. И няма как да бъде иначе с оглед на потенциалното им приложение в клиничната практика.
От ваксините срещу COVID-19 такава е подготвяната от Inovio Pharmaceuticals.
- Вирусоподобни частици
Това са молекули, които имитират вируса, но не са инфекциозни и не могат да ни разболеят, тъй като не са пълноценни вируси. Разпознати са като обещаваш способ за създаване на ваксини срещу заболявания, предизвикани от хепатит В вируса, човешките папиломни вируси и др. Образно казано, представляват обвивката на вируса, обсипана с белтъка (антигена), необходим за активиране на имунния отговор. Такива са ваксините срещу COVID-19, разработени от канадската биофармацевтична компания Medicago (намира се във Фаза 3 на клинични изпитвания) и Серумния институт в Индия (Фаза 1 / 2). В началото на месец ноември 2020 г. списание “Cell” съобщи за интересен подход при създаване на ваксина срещу COVID-19. Изработена е от миниатюрни изкуствени частици (наночастици), имитиращи структурата на коронавируса. Върху повърхността им са нанесени 60 копия на S-белтъка (шипчето). Въведена в мишка, тя предизвиква образуване на 10 пъти повече неутрализиращи антитела в сравнение с ваксина, която съдържа само едно шипче.
Някои от тези ваксини (живите, убитите, субединичните) отдавна са навлезли в клиничната практика. За други обаче (като РНК и ДНК ваксините например) науката се е подготвяла в продължение на десетилетия. За да може да даде най-доброто от себе си именно сега, когато толкова силно се нуждаем от надежда за спасение.
Както се вижда, всеки тип ваксина има своите силни и слаби страни. Важно е да се познават особеностите на отделните ваксини, да се търси и прилага най-подходящата ваксина за всеки отделен човек. Последното не винаги е лесно
Странични ефекти на ваксините
Безвредността е едно от основните изисквания към ваксините и лекарствата. Това е основният принцип на медицината – преди всичко да не вреди. Няма такъв медицински продукт, който да е в 100% от случаите и при всички хора напълно лишен от странични ефекти. Достатъчно е да прочетем внимателно упътването дори на онези хапчета от домашната аптечка, към които често посягаме, без дори да се замислим. Важното е нежеланите странични реакции да бъдат минимални в сравнение с ползата, която лекарството или ваксината осигуряват.
А сега, нека обърнем поглед към ситуациите, които биха могли да възникнат при прилагане на ваксини:
- Страничните ефекти може да са предизвикани от самата ваксина и да са резултат от взаимодействието й с индивидуалните особености на всеки отделен човек. Т.е. става дума за реакции, които не биха се проявили, ако ваксината не е приложена. Подобни нежелани събития обикновено е много трудно да бъдат предвидени. Пример за това е ваксино-инициираният полиомиелит, за който вече стана дума;
- В други случаи човекът е предразположен към определен вид реакции и ваксината просто е един от факторите, които я отключват. Нежеланият ефект обаче би се проявила и при други обстоятелства;
- Проблеми с ваксините може да възникнат поради грешки и неспазване на технологията на производство, изискванията за транспортиране и приложение. Пример за такова нежелано събитие е произведена през 1955 г. партида с убита ваксина срещу полиомиелит от фирмата „Cutter“, в която вирусът не е бил достатъчно инактивиран. Това става причина 260 от ваксинираните с нея деца да се разболеят, а 10 от тях да загубят живота си. Избягването на подобни инциденти е въпрос на стриктно спазване на технологичния режим и прилагане на строг качествен контрол;
- Не на последно място, възможно е ваксината да не е причина за наблюдаваните странични ефекти, а да става дума за съвпадение по време и място на независими събития.
Натрупаният до момента опит с ваксините е показал, че са познати нежелани реакции, които се проявяват в 1 на 1 000 000 и дори повече ваксинирани. Възможните странични реакции може да са толкова редки, че за тях да научим дълго време след навлизането на ваксината в клиничната практика при обхващане на голям брой хора. Алергични реакции не са наблюдавани по време на клиничните проучвания върху създадената от Pfizer/BioNTech ваксина срещу COVID-19 (с около 44 000 участника, от които половината са получили ваксината, а другата половина т.нар. плацебо), но са установени (6 случая до 19.12.2020 г.) при последвалото ваксиниране на над 270 000 души.
Контролът върху безопасността на ваксините продължава и след като те бъдат одобрени за приложение и навлязат в реалния живот.
Противопоказания на ваксините
Това е състояние, което прави определено лечение или процедура, каквото е и приложението на определена ваксина, нежелателно. Противопоказанията по отношение на ваксините могат да бъдат постоянни (например известна силно изразена алергия към компонент на ваксината) или временни (наличие на остро инфекциозно заболяване или остро фебрилно състояние и др.). В случай, че е налице алергия към някоя от съставките на ваксината, подходът за решаване на проблема зависи от конкретната ситуация. Може да се използва друг вид ваксина срещу същото заболяване (ако има избор). Или пък да се вземат предварителни мерки (т.нар. премедикация), които да предотвратят риска от тежка алергична реакция – в този случай медицинският екип внимателно преценява ползата от ваксината и рисковете от прилагането й
Съхранение на ваксини
При съхраняването и транспортирането на всяка ваксина се спазват определени условия, за да се запази биологичната й активност. Всички ваксини са повече или по-малко чувствителни към топлина. Непрекъснатото поддържане на необходимите температурни условия от производството на ваксината до момента на използването й се нарича хладилна или студена верига.
Въпреки че ваксините на Pfizer/BioNTech и Moderna са от един тип – иРНК ваксини, температурните им изисквания се различават, най-вероятно в резултат от различните наночастици, които са използвани като обвивка/носител. Ваксината на Pfizer/BioNTech изисква поддържане на -75°С и може да издържи до 5 дена в хладилник при 2°С до 8°С. От Moderna заявиха, че са подобрили срока на годност и стабилността и тяхната ваксина може да се съхранява в продължение на шест месеца при -20 °С (обикновен фризер) и при стандартни температури на охлаждане от 2°С до 8°С в продължение на 30 дни, както и 12 часа при стайна температура, непосредствено преди прилагането й. За сравнение, ваксината срещу варицела също се съхранява при -20°С. „Отличникът“ сред РНК ваксините срещу COVID-19 е произведен от CureVac и по данни от Компанията може да се съхранява при 2°С до 8°С до три месеца, а в продължение на 24 часа (непосредствено преди употребата) и на стайна температура.
Предклинични и клинични проучвания при ваксини
Изпитването на ваксините започва с предклинични проучвания при клетъчни култури (култивирани в лабораторни условия клетки от животни или хора) и лабораторни животни. Клиничните проучвани се осъществяват при хора – доброволци. Първите две фази включват съответно десетки и стотици здрави доброволци, а целта е да се изследва безопасността на ваксината и способността й да предизвика образуване на имунен отговор, да се уточнят подходящите дози за приложение. Предизвиканият от ваксината имунен отговор се сравнява с този, който се получава в резултат от естествена инфекция с вируса. В третата фаза наблюденията върху безопасността продължават, но на дневен ред излиза и въпросът за ефективността. Броят на доброволците вече е десетки хиляди (например 30 000 при Moderna и почти 44 000 при Pfizer/BioNTech). Това е последният етап на клинични проучвания, след който, ако всичко е наред, медицинският продукт може да бъде одобрен за употреба. В САЩ одобрението се дава от Агенцията за контрол на храни и лекарства (Food and Drug Administration), а в Европа от Европейската агенция по лекарствата (European Medicines Agency).
Безопасността на ваксините отразява безвредността им за нашето здраве, а ефективността им е израз на потенциала им да ни предпазят от съответното заболяване.
При провеждането на клинични проучвания половината от доброволците получават истинската ваксина, а другата половина т.нар. плацебо (безобиден материал, „фиктивна инжекция“ – най-често разтвор на натриев хлорид във вода, т.е. физиологичен разтвор). Данните са кодирани и никой от участниците, както и от екипа, провеждащ изследването, не знае кой в коя група е. Те ще бъдат разсекретени, когато дойде време за анализ на резултатите. Идеята е да се сведе до минимум влиянието на субективния фактор.
Обхванатите в клиничните изследвания доброволци трябва да отговарят на редица изисквания, които са строго регламентирани в съответното проучване. Ако се върнем при ваксините срещу COVID-19, включени са хора на различни възрасти, здрави и с придружаващи заболявания, както и представители на различни етноси. Целта е да се получи колкото се може по-пълна и обективна информация за различните групи хора.
Няколко примера:
- Във фаза 2/3 на клиничните проучвания на ваксината на Pfizer/BioNTech влизат доброволци на възраст от 12 години нагоре, разпределени в 3 подгрупи – 12-15 години; 16-55 години и над 55 години, а във фаза 1 участниците са били от 18 до 55 години и между 65 и 85 години.
- Във Фаза 1 на клиничните проучвания на Moderna са изпитани три дози – 25µg, 100 µg и 200 µg. Последната отпада от по-нататъшни изследвания поради предизвиканите от нея по-силно изразени странични ефекти (без никой от тях да е бил живото застрашаващ). За Фаза 3 експертите се спират на дозата 100 µg, защото осигурява по-добре изразен имунен отговор в сравнение с 25 µg, като страничните ефекти и при двете дози са били сходни и приемливи.
Обхванати са и хора със съпътстващи заболявания – вече знаем, че по-високата възраст и/или наличие на придружаващи заболявания повишава риска от тежък COVID-19. Изискването към тези доброволци е през последните три месеца, преди включването им в клиничното изпитване, здравословното им състояние да е било стабилно – да не се е налагала промяна в терапията или хоспитализация.
Едно от големите предизвикателства пред ваксината за COVID-19 е, че тя трябва да е ефективна и при хора над 65 години и /или с придружаващи заболявания, а изграждането на имунен отговор при тях понякога е затруднено.
Клинични проучвания при малки деца и бременни жени се провеждат, когато безопасността на ваксината е потвърдена при други групи хора. Затова включването на жени в детеродна възраст в проучванията (на Moderna например) е след отрицателен тест за бременност в деня на въвеждане на първата доза на ваксината. Необходимо условие е и прилагането на надеждна контрацепция от 28 дена преди първата доза (при жените) до 3 месеца след въвеждането на втората доза (при жените и мъжете).
Проследяването на ефективността на ваксините, характера и продължителността на имунния отговор, който те предизвикват, както и тяхната безопасност, продължава и след навлизането им в реалния живот - т.е. в рутинната клинична практика, при която те ще достигнат до стотици хиляди и милиони души. По същество, това е т.н. четвърта или „пост-маркетингова” фаза на клиничното проучване.
Защо ваксините срещу COVID-19 бяха създадени толкова бързо?
Обикновено „придвижването“ на ваксината от лабораторията до аптеката/ръцете на лекаря изисква поне десетилетие – време, необходимо за разработване, тестиране и производство. Само за илюстрация – получаването на ваксината срещу варицела е продължило 28 години, а срещу човешкия папиломен вирус (HPV) и ротавирусите – 15 години. Шест години са нужни на д-р Йонас Салк, за да даде на света първата ваксина срещу полиомиелит, започвайки с изолирането на вируса.
За разлика от това, Pfizer/BioNTech и Moderna (и не само те, разбира се) разработват ваксина за по-малко от година. След разчитането на генома на вируса, причиняващ Covid-19, в началото на януари 2020 г., само за два месеца бяха създадени поне 20 модела на ваксина, а днес (данните са от 22 декември 2020 г.) техният брой надхвърля 230. И няма начин да не се запитаме как е възможно това. Ето част от факторите допринесли това да се случи:
- Класическите ваксини обикновено използват отслабена версия на вируса или белтъчна част от него. Размножаването на вируса (а за изработване на ваксина са нужни огромни количества вирус) става в кокоши ембриони или клетъчни култури и изисква много време. За разлика от това, използването само на генетичен материал за шипчето (S белтъка на виурса) значително облекчава процеса. иРНК може лесно да бъде синтезирана в лабораторни условия. Така, разработването на РНК ваксина, вместо белтъчна ваксина или такава с цял вирус, спестява месеци, ако не и години;
- Едновременно провеждане на предклинични и клинични проучвания или на две фази на клинични проучвания;
- Бързото и ефективно набиране на доброволци за клиничните проучвания;
- Големите клинични изпитвания за безопасност и ефективност се извършват едновременно с мащабни подготовка за евентуално производство. Обикновено това се прави, когато клиничните проучвания вече са приключили. В случая на COVID-19 обаче, целта е да се осигури готовност за разпространение на ваксината в момента, в който резултатите от Фаза 3 са известни и данните за безопасността са анализирани. За постигането й фармацевтичните компании направиха рискови инвестиции – това стана възможно с финансовата подкрепа на институциите и държавите. Така, ако съответната ваксина получи разрешение за употреба по спешност, нейното производство може веднага да започне;
- Натрупаният до момента опит при създаване на ваксини от различен тип и срещу различни инфекциозни агенти, включително близките роднини на SARS-CoV-2 – причинителите на тежкия остър респираторен синдром (SARS-CoV-1, предизвикал епидемията през 2002-2003 г.) и близкоизточния респираторен синдром (MERS-CoV, появил се през 2012 г.);
- Мобилизирането на огромен научен и финансов ресурс;
- Цялостният напредък в развитието на биомедицинските науки през последните години. Както и невероятните професионализъм и всеотдайност на учените от целия свят, които ежедневно се състезават с вируса и с времето.
Какво представлява т.нар. „разрешение за спешна употреба“
Макар повечето хора за пръв път да чуват този термин сега, той далеч не е от вчера. Това е регулаторен механизъм, който позволява обществеността да получи достъп до обещаващи медицински продукти, които все още не са официално одобрени и лицензирани от съответните регулаторни органи. Което се случва при изключителни обстоятелства и ако са изпълнени определени условия от страна на медицинските продукти, които кандидатстват за придобиването му. Чухме за стъпките, които предприема в това отношение Американската агенция за храни и лекарства. Световната здравна организация задейства процедура за Emergency Use Assessment and Listing (EUAL, изпитване и включване в Списъка за спешно приложение при извънредни обстоятелства). Подобна ситуация е възникнала през 2016 г., по време на бушуващата епидемия от хеморагичната треска Ебола в Африка (смъртността е била 40%), когато властите в Гвинея отправят молба към СЗО за т.нар. разширен достъп до експериментална ваксина срещу вируса-причинител. Получаването на подобно разрешение в никакъв случай не означава компромис – продуктите трябва да отговарят на съответните норми и стандарти за качество, да е ясно, че очакваните ползи значително надвишават съответните предвидими рискове, информацията за тях да е напълно прозрачна и достъпна. Така че ваксините срещу COVID-19 които достигат и ще достигнат до нас, трябва да бъдат качествени, безопасни и ефективни. С уговорката, че няма как да знаем съвсем всичко за тях, за някои неща просто е нужно време.
Как се определя ефективността на ваксината
Ако се работи с лабораторни животни, сценарият е следният – половината от тях се ваксинират, другата половина не. След което всички биват инфектирани със съответния инфекциозен причинител и данните за двете групи се сравняват – за заболеваемостта, протичането на инфекцията и изхода от нея. Ясно е, че в случая с COVID-19 при хора, това не е вариант. Затова и предвиденият план за действие е съвсем различен според Американската агенция за контрол на храни и лекарства (FDA): изчаква се да бъдат регистрирани 32 случая на COVID-19 и се провежда първият анализ на данните. Ако се окаже, че по-малко от 6 души са от ваксинираната група, значи ваксината е ефективна. Следващата „спирка“ е при 64 доказани случая на COVID-19 и т.н. И двете компании (Pfizer/BioNTech и Moderna) докладват междинни данни от клиничните изпитвания във Фаза 3, получени, съответно при 94 и 95 доказани случая. Установената ефективност и при двете ваксини е над 90%. За доказан случай на COVID-19 се приема човек, при когато е наличен позитивен тест за инфекция със SARS-C0V-2 от проведена полимеразна верижна реакция и поне един клиничен симптом на заболяването.
Само за илюстрация: В проучването на Moderna само пет от случаите на COVID-19 са били при ваксинирани участници, останалите 90 са при представители на групата с плацебо. Докладваната ефективност е 94,5%. Тежък COVID-19 е диагностициран в 11 случая, всичките са при участници от групата, приемала плацебо.
В кой момент ваксините може да кандидатстват да разрешение за спешна употреба
В съответствие с указанията на Американската агенция за контрол върху храни и лекарства (FDA), компанията – производител може да подаде документи за получаване на разрешение за спешна употреба в условия на пандемия, когато са изпълнени следните две условия:
- Най-малко половината от доброволците в клиничното проучване във Фаза 3 да са наблюдавани за странични ефекти в продължение на поне два месеца след приема на ваксината (след втората доза при двукратен прием);
- Ефективността на ваксината да бъде демонстрирана след 150-165 потвърдени случая на COVID-19.
Ваксините на Pfizer/BioNTech и Moderna – първите лястовички на една дългоочаквана пролет
И в двата случая става дума за РНК ваксина, в която е записана информация за „шипчето“ на SARS-CoV-2 (т.нар. S протеин).
Moderna е първата компания, чийто продукт влезе в клинични изпитвания при хора. Случи се още на 16 март 2020 г. Pfizer и BioNTech пък са първите, които споделиха данни за получените междинни резултати във Фаза 3 на клиничните изпитвания, направиха го на 9 ноември 2020 г. Седмица по-късно – на 16 ноември 2020 г., обнадеждаваща информация дойде и от Moderna.
Ваксина на Pfizer/BioNTech
На 11 декември 2020 г. ваксината на Pfizer/BioNTech получи разрешение за спешна употреба за предотвратяване на COVID-19, причинен от SARS-CoV-2, при лица на 16 и повече години, от Американската агенция за контрол върху храни и лекарства (Food and Drug Administration - FDA). Десет дни по-късно – на 21 декември 2020 г., Европейската агенция по лекарствата (EMA) препоръча използването на ваксината в страните от Европейския съюз и проправи пътя за започване на ваксинациите в Европа на 27 декември 2020 г. Включително и в България.
Ефикасността на ваксината е изчислена при 36 523 души на възраст над 16 години (включително хора над 75 години), които нямат признаци на предишна инфекция. Като цяло сред общия брой участници в клиничното проучване във Фаза 3 9,1% са чернокожи или афроамериканци, 28,0% са испанци/латиноамериканци, 4,3% са азиатци и 0,5% са представители на местното население (индианци и жители на Аляска).
Клиничното проучване показва 95% намаляване на броя на симптоматичните случаи на COVID-19 при ваксинираните участници (8 случая на COVID-19 при 18 198 ваксинирани доброволци) в сравнение с хората, които са получили плацебо (162 случая на COVID-19 от 18 325 участници от групата с плацебо). От тези 170 случая на COVID-19, 1 във ваксиналната група и 3 в групата с плацебо са класифицирани като тежки.
Установена е ефикасност на ваксината и при участниците със съпътстващи заболявания (включително астма, хронично белодробно заболяване, диабет, високо кръвно налягане или затлъстяване), които са в повишен риск от развитие на тежък COVID-19. Високата ефикасност се запазва при половете, расовите и етническите групи.
Ваксината на Pfizer/BioNTech се прилага интрамускулно като серия от две дози (по 0,3 ml) с интервал от 3 седмици. Ваксината не е проучена за употреба като единична доза.
Ваксина на Moderna
РНК ваксината на разположената в Кеймбридж, Масачузетс, биотехнологична компания Moderna e разработи в сътрудничество с изследователите от Центъра за изследване на ваксините, част от Националния институт по алергии и инфекциозни болести в САЩ. На 18.12.2020 г. тя получи разрешение за спешна употреба от FDA за приложение при хора на и над 18 години с цел предотвратяване на COVID-19. Проведените клинични проучвания показват 94.1% ефективност след прием на две дози (по 0.5 ml) с интервал от 4 седмици. Получените резултатите предполагат, че ваксината е ефективна при възрастни и хора с различен етнически произход. Около 42% от участниците в клиничното проучване са по-възрастни или имат съпътстващи заболявания като диабет, затлъстяване или високо кръвно налягане. Проучването на Moderna не включва деца (за сравнение, в проучването на Pfizer/BioNTech участват деца и юноши от 12 години нагоре).
Какво още не знаем за ваксините на Pfizer/BioNTech и Moderna
Най-напред по отношение ваксинирането на специфични групи хора
- Имунокомпрометирани лица
Понастоящем няма данни за безопасността и ефикасността на тези ваксини при имунокомпрометирани хора. Пациенти със стабилна ХИВ инфекция са били включени в клинично изпитване на ваксини за COVID-19, но наличната информация е доста ограничена. Според CDC (Centres for Disease Control and Prevention) в САЩ такива хора могат да бъдат ваксинирани ако нямат противопоказания, но те трябва да бъдат предупредени за неизвестния профил на безопасността и ефикасността на ваксината в този случай. Както и за необходимостта да продължат да спазват мерките, тъй като е възможно да не изградят необходимия имунен отговор.
- Хора с автоимунни заболявания
Липсват данни за безопасността и ефикасността на РНК ваксините срещу COVID-19 при хора с автоимунни заболявания, въпреки че те са имали право да бъдат включени в клиничните проучвания. Специалистите от CDC са на мнение, че такива хора също може да бъдат ваксинирани, стига да не са налични противопоказания.
- Бременни жени
Бременни жени не са били включвани в клиничните изследвания до момента, но такива проучвания са в процес на планиране. Въз основа на познанията, с които разполагаме, се смята, че РНК ваксината е малко вероятно да представлява риск за тях. В подкрепа на това са и наблюденията при плъхове, които са били инжектирани с ваксината на Moderna преди или по време на бременността – проследено е влиянието върху женската репродуктивна система, развитието на ембрионите и новородените. Тревожни сигнали не са получени.
Предполага се, че РНК ваксините срещу COVID-19 не представляват риск при кърмене, но проучвания в това отношение не са правени.
Странични ефекти при прилагането на ваксините
Досега клиничните проучвания на ваксините, създадени от Pfizer/BioNTech и Moderna, не са открили сериозни странични ефекти. Не са установени опасения за безопасността свързани с възраст, раса, етническа принадлежност, съпътстващи заболявания или предишна инфекция с SARS-CoV-2. До момента е налична информация за следните странични ефекти:
- Локални - болка, подуване, зачервяване на мястото на инжектирането, подуване на лимфните възли от страната на ваксинацията;
- Системни – повишаване на температурата, умора, главоболие, втрисане, болка в мускули и стави.
80-89% от ваксинираните съобщават за поне един локален страничен ефект, а 55-83% са изпитали поне един от групата на системните реакции. Повечето от споменатите симптоми са с лека до умерена тежест и отзвучават за 1 до 3 дена. По-чести и по-изразени са след получаването на втората доза и при по-млади в сравнение с по-възрастните хора.
Допълнителни нежелани реакции, някои от които може да са сериозни, могат да станат очевидни при по-широкото използване на ваксината Pfizer/BioNTech.
Това, което определено привлече вниманието на специалистите и на цялата общественост през последните дни са докладваните случаи на тежки алергични реакции (т.нар. анафилактична реакция). Към 19 декември 2020 г. са наблюдавани 6 такива случая сред общо 272 001 ваксинирани с продукта на Ffizer/Biontech. Настъпили са до 30 минути след поставянето на ваксината. Това наложи CDC да публикува указания, с които препоръчва всички ваксинирани да бъдат наблюдавани в продължение на 15 минути след манипулацията. Този период трябва да е удължен до 30 минути при хора, с предшестваща история (анамнеза) за тежки алергични реакции и да се осъществява в медицинско заведение, което може да осигури бързо лечение, ако възникне нежелано събитие.
CDC съветва хората, които са имали сериозна алергична реакция към някакво инжекционно лекарство или ваксина в миналото, да се консултират със своя лекар. Особено внимание заслужават хората, при които има данни за алергия към някоя от съставките на ваксината. Мнението на експертите е, че тези хора може да бъдат ваксинирани, но трябва да бъдат наблюдавани за по-дълъг период от време. В медицината са добре познати не едно и две лекарства, чието приложение може да предизвика алергична реакция. Едно от решенията за преодоляване на този проблем е провеждането на предварителна подготовка (т.нар. премедикация).
Макар потенциално да е животозастрашаващо състояние, анафилактичната реакция може лесно да бъде овладяна.
Все още не е ясно, коя е причината за отключването на алергична реакция
Произведените от Pfizer/BioNTech и Мoderna ваксини не включват консерванти, а запушалките на флаконите не са изработени от латекс (добре известен алерген). Пълен списък за съставките на ваксините може да се намери в предоставената от фирмите и институциите информация за тях. Във ваксината на Moderna влизат различни липиди, натриев ацетат и трометамин (кеторолак – лекарство от групата на нестероидните противовъзпалителни средства). Натриев хлорид, калиев хлорид и редица липиди са включени в съдържанието на ваксината на Pfizer/BioNTech.
Възможно ли е причина за наблюдаваните алергични реакции да е съединението полиетилен гликол (ПЕГ), което присъства и в двете ваксини? С него са „посипани“ наночастичките, в които е обвита иРНК на ваксината. Процесът, наречен пегилиране, при който наночастиците се покриват с ПЕГ, за да бъдат „скрити“ от имунната система на организма и да не бъдат елиминирани от нея преди да са изпълнили задачата си да доставят товара (напр. лекарство, а в случая ваксина), който носят до крайната цел, е добре известен в биомедицината. Дълго време се смяташе, че ПЕГ е напълно инертен, но според някои наблюдения това не е така и той може да предизвика имунен отговор.
ПЕГ никога не е бил използван във ваксини, но той влиза в състава на някои лекарства, при които също е описана анафилактична реакция. Според някои алерголози и имунолози, хора, които преди това са били изложени на действието на ПЕГ, е възможно да притежават антитела срещу него, което ги излага на по-висок риск от анафилактична реакция при прилагане на ваксината. Други специалисти изразяват скептицизъм по темата. Националният институт по алергология и инфекциозни болести и Агенцията за контрол на храни и лекарства в САЩ започват проучвания в тази посока.
Специалистите са на мнение, че предизвиканите от ваксините странични ефекти показват необходимост от отлична информираност, а не от тревога.
Може ли ваксината да предизвика автоимунна реакция
За момента подобна информация няма. Не бива да забравяме обаче, че между самите вируси и автоимунните реакции определено съществува връзка, макар тя все още да не е изяснена толкова добре, колкото ни се иска на нас, учените. На специалистите отдавна е направило впечатление, че вирусни инфекции може да повлияят върху клиничната картина на редица автоимунни заболявания, сред които диабет тип 1, системен лупус еритематозус, ревматоиден артрит, целиакия, множествена склероза и др. Предполагат се различни механизми, чрез които вирусите са в състояние да допринесат за отключване на автоимунни реакции, ето някои от тях:
- Т.нар. молекулна мимикрия – редица вируси притежават структури, които наподобяват молекули в организма на човека и животните. Най-вероятно до това се е стигнало в хода на хилядолетната ни съвместна еволюция - може би вирусите са се опитали да заприличат на своите гостоприемници в стремежа си да се скрият от имунната им система. Изграденият срещу подобни чужди структури имунен отговор би могъл да се обърне и срещу собствените;
- Като модифицират повърхността на инфектираните от тях клетки - в резултат имунната система може да престане да ги възприема като собствени и да започне да ги атакува;
- Вирусите може да „обезсмъртят“ автореактивни клетки на имунната система – т.е. клетки, които, по една или друга причина, реагират срещу собствените ни клетки и тъкани.
Всеки един от нас през живота си бива инфектиран от много и различни вируси. С някои от тях това се случва нееднократно. И опитът показва, че до описаните по-горе усложнения се стига доста рядко. И все пак, кои са предразполагащите фактори, които създават условия да се разгърне автоимунна реакция? Въпросите все още са повече от отговорите, проучванията продължават.
Установени са някои прилики между участъци в белтъци на SARS-CoV-2 и човешки белтъци. Това кара специалистите да си задават въпроса дали в някои случаи (и в кои?) вирусът предизвиква автоимунна атака, при която имунният отговор предназначен да елиминира вируса в крайна сметка атакува и здрави клетки. И тази атака може да продължи дълго след като самият вирус бива унищожен. Възможно ли е тези автоимунни явления да обяснят защо понякога миокардит и други форми на възпаление или увреждане се появяват седмици или месеци след като човек привидно се е възстановил от коронавирусната инфекция? Това ли е причината силен имунен отговор към вируса - такъв, който включва производството на неутрализиращи антитела - не винаги да се съпътства от леко протичащ Covid-19.
Какво не знаем още за ваксините срещу COVID-19?
И все пак, има ли неща, които не знаем, а е важно да научим? Да, има. Ето някои от тях:
- От какво точно ни пази ваксината – от това да се разболеем въобще или да боледуваме тежко?
- Ще предотврати ли напълно и предаването на вируса?
- Колко време ще продължи защитата?
- Ще има ли разлика в имунния отговор, изграден от хора на различни възрасти? А от хора с различни съпътстващи заболявания?
В рамките на само няколко месеца няма как да научим всичко за която и да е ваксина.
Просто е нужно още време, за да намерим отговорите.
Други ваксини срещу COVID-19
За ваксините, произведени от Pfizer/BioNTech и Moderna се говори и пише доста напоследък. По-долу ще представим кратка информация и за част от останалите ваксини, намиращи се в напреднали фази на клинични проучвания - продуктите на Университета в Оксфорд и компанията AstraZeneca, на фирмите CureVac, Janssen Pharmaceuticals, Sanofi-GSK, Medicago, Novavax, руската ваксина „Спутник 5“. С което, разбира се, списъкът не се изчерпва.
- РНК ваксината на CureVac
Немската биотехнологична компания CureVac е разработила иРНК ваксина, която се различава от тези на Pfizer/BioNTech и Moderna, включително и по използвания за стабилизиране на РНК молекулата подход – ваксината може да се съхранява за поне 3 месеца при температура 2-8оС и до 24 часа непосредствено преди инжектирането - на стайна температура.
CureVac е основана през 2000 г. (любопитна подробност е, че основателят й е бил докторант по това време), а от портфолиото й става ясно, че цели използване на иРНК за медицински цели – интересите на специалистите в нея са насочени към прилагане на този вид ваксини при бяс, жълта треска, респираторно синцитиален вирус, близкоизточен респираторен синдром (MERS), грип както и ракови заболявания.
На 14 декември 2020 г. започна третата фаза (Фаза 2в/3) на клинично изпитване на ваксината срещу COVID-19 с повече от 35 000 доброволци на възраст от 18 години нагоре в Европа и Латинска Америка.
Това става след успешно приключила първа фаза, при която са изпитани различни дози на ваксината; установено е изработване на имунен отговор; избрана е и дозата, която ще бъде приложена при доброволците по време на третата фаза.
- Ваксина на Университета в Оксфорд и AstraZeneca
Неотдавна компанията съобщи за междинни резултати от Фаза 3 на клинично проучване, проведено във Великобритания, Южна Африка и Бразилия. Анализът е направен след 131 случая на COVID-19 (30 във ваксинираната група и 101 в групата приемала плацебо), като в групата на ваксинираните участници няма хоспитализирани хора или тежко протичащи случаи на заболяването. Приложени са два режима на ваксиниране:
1/ 2 доза ваксина и след месец цяла втора доза – регистрирана е 90% ефективност;
Последователен прием на две пълни дози на ваксината, при което е наблюдавана 62% ефективност.
Комбинираният анализ дава средна ефективност от 70%. И двата режима се понасят добре. Резултати от това проучване бяха публикувани на 8.12.2020 г. в списание “The Lancet”.
Още преди излизането на статията, изнесените от създателите на ваксината междинни резултати предизвикаха някои критики от страна на специалистите. Причината е, че по-високата докладвана ефективност (90%) е регистрирана при сравнително малка група доброволци (3000 души), които са били под 55 годишна възраст. Всички те са били ваксинирани с половин и след това с цяла доза ваксина. Този режим не е бил предварително планиран и е плод на случайност. Не е ясно защо тази схема работи по-добре. Едно от възможните обяснения е, че намалената първоначална доза на ваксината предизвиква по-слабо изразен имунен отговор срещу самия аденовирус в сравнение със стандартната доза. Съществуването/изграждането на антитела срещу аденовирусния вектор е едно от големите предизвикателства при този тип ваксини. Да не забравяме и това, че участниците са били на по-млада възраст (под 55 г.). Някои експерти отбелязват, че в тази група липсва достатъчно етническо многообразие, както и баланс на участниците от двата пола. Клиничните проучвания продължават, провеждат се в САЩ, Япония, Русия, Южна Африка, Кения и Латинска Америка. Компанията очаква да обхване общо 60 000 участника в целия свят. Натрупващите се данни ще позволят осъществяване на допълнителен анализ, прецизиращ заключенията за ефикасността на ваксината и установяване на продължителността на защитата.
На 11.12. 2020 г. от AstraZeneca съобщиха за предстоящи съвместни клинични проучвания със създателите на руската ваксина „Спутник V“, при които ще бъде изпитана комбинация от британската ваксина и компонент (един от аденовирусните вектори в състава на „Спутник V“), който е създаден в Москва.
Ваксината може да се съхранява при нормални хладини условия (2-8оС) в продължение на 6 месеца, а компанията заяви готовност да произведе три милиарда дози ваксина. Очакваната цена на ваксината на AstraZeneca е по-ниска в сравнение с тази на Pfizer/BioNTech и Moderna. Смята се, че ваксината на AstraZeneca е изключително важна за овладяване на епидемията в развиващите се страни, тъй като е по-евтина и по-лесна за разпространение.
- Базирана на аденовирусен вектор ваксина на Janssen Pharmaceuticals
До момента компанията е приложила същия подход при създаване на ваксина срещу вирусите Ебола и Зика. Натрупала е наблюдения върху 110 000 доброволци, обхванати от изследователските програми, по които работи.
На 15 ноември 2020 г. започна едновременното провеждане на две проучвания във Фаза 3 на ваксината срещу COVID-19, при които ще бъде изпитано прилагането на два режима: с една доза на ваксината (с 60 000 доброволци) и на две дози (с 30 000 участници).
Резултатите се очакват с голям интерес, тъй като еднократна ваксина с доказана безопасност и ефективност би била изключително полезна, особено в условия на пандемия. Резултатите от Фаза 1/2а са показали, че единичната доза на тази ваксина предизвиква силен имунен отговор и се понася добре. Клиничните проучвания във Фаза 3 ще обхванат възрастни на 18 и повече години без и със съпътстващи заболявания, които са с повишен риск от тежък COVID-19. Целта е да се оцени ефикасността на изследваната ваксина след първа и втора доза, за да се разбере дали прилагането на втората доза би донесло допълнителна полза. От фирмата изразиха намеренията си да включат в проучването участници от Белгия, Франция, Германия, Испания, Великобритания, САЩ, Колумбия, Филипините, Южна Африка. Избрани са райони с висока честота на COVID-19.
- Ваксината „Спутник V“
Руската ваксина „Спутник V“ е създадена от Националния изследователски център по епидемиология и микробиология „Н. Ф. Гамалея“ в гр. Москва. Става дума за съдържаща два различни аденовирусни вектора ваксина. Привлече вниманието на световната научна (и не само) общност в началото на месец август 2020 г., когато получи одобрение от регулаторните органи в Русия за приложение срещу COVID-19.
Резултатите от клиничните проучвания във Фаза 1 / 2 бяха публикувани в списание “The Lancet”. Сред ограниченията на тези изследвания, за които самите автори съобщават в статията, са: фактът, че в някои части на страната в тях са били включени само мъже; макар възрастта на участниците да е била от 18 до 60 години, повечето от тях са били млади хора; краткият период на проследяване – 42 дена. Ваксината е във Фаза 3 на клинични проучвания, а през месец ноември 2020 г. беше съобщено, че ефикасността й е 92%. Предлага се в две форми – замразена (при -18оС) и лиофилизирана (предназначена за доставка в труднодостъпните райони на Русия).
На 21 декември 2020 г. от Русия дойде новината, че създателите на „Спутник V“ са подписали споразумение с компанията AstraZeneca за съвместно изпитване на комбинация от британската ваксина и компонент, който е създаден в Москва.
- Субединичната ваксина на Novavax
Субединичната ваксина на Novavax е създадена чрез рекомбинантна нанотехнология и съдържа патентования от фирмата адювант. Клиничните проучвания във Фаза 1/ 2 са показали, че се понася добре и предизвиква образуване на антитела, чиито нива превъзхождат значително наблюдаваните при възстановени от инфекция със SARS-CoV-2 хора. В момента ваксината е във Фаза 3 на клинични проучвания, като същевременно продължават и проучвания във Фаза 2. В Южна Африка се изпитва и при хора със стабилна ХИВ инфекция. Прилага се интрамускулно в две дози с интервал от 21 дена.
- Рекомбинантна ваксина на Sanofi- GSK
При изработването на тази ваксина са съчетани рекомбинантната технология на Sanofi и изобретеният от Glaxo Smih Kline (GSK) адювант - утвърдена платформа за създаване на ваксини, която се оказаха успешна срещу грип.
При предклинични проучвания на ваксината срещу COVID-19 при нечовекоподобни маймуни е установено, че тя намалява нивата на вируса в горните и долните отдели на дихателната система и предпазва от развитие на усложнения в белите дробове в продължение на повече от 200 дена. Проведени са и клинични проучвания Фаза 1 / 2 при 440 здрави възрастни в 10 изследователски центъра в САЩ. Участниците са получили 1 или 2 дози ваксина или плацебо с интервал от 21 дена.
Междинните резултати показват:
Наличие на неутрализиращи антитела след две дози ваксина сравними с тези на пациенти, възстановили се от COVID-19 при средно 88% от участниците: 89.6% при тези на възраст 18-49 г; 85% при > 50 г.; 62.5% при > 62 г.
Наблюдавани са преходни, но по-високи нива на реактогенност (странични ефекти), вероятно поради неоптимална формулировка на използвания във ваксината белтък (антиген). Сериозни нежелани събития не са регистрирани.
Недостатъчният имунен отговор при хора над 62 години показва необходимост от оптимизиране на ваксината, за да се осигури надеждна защита във всички възрастови групи.
Фаза 2в е планирана да започне през февруари 2021 г. Ако всичко е благополучно, Фаза 3 ще стартира през второто тримесечие на 2021 г., а продуктът се очаква да бъде наличен в края на 2021 година.
- Съдържаща вирусоподобни частици ваксина на Medicago
Medicago e биофармацевтична компания със седалище в гр. Квебек, Канада, основана през 1999 г. Компанията използва иновативни растителни технологии за производство на ваксини и други терапевтични продукти за бърза реакция на възникващи глобални предизвикателства. Названието й идва от латинското име на люцерната (Medicago sativa). Целта е растенията да бъдат използвани като малки биореактори за производство на ваксини и терапевтични антитела. Потенциалът на Компанията е доказан през 2009 г., когато разработва само за 19 дkr кандидат-ваксина срещу предизвикалия пандемия грипен вирус H1N1 (станал известен като „свински грип“). През 2015 г. произвежда коктейл от моноклонални антитела срещу вируса Ебола за нуждите на биомедицинския орган за напреднали изследвания и развитие (Biomedical Advanced Reseach and Development Authority – BARDA), който е част от Министерството на здравето и социалната политика на САЩ.
На 12.11.2020 г. от Medicago обявиха началото на клинични проучвания Фаза 2 / 3 на техния кандидат за ваксина срещу COVID-19, в която създадените от тях вирусоподобни частици ще бъдат комбинирани с адюванта на GSK (Glaxo Smith Kline).
- ДНК ваксина на Inovio Pharmaceuticals и International Vaccine Institute
Inovio Pharmaceuticals е американска биотехнологична компания, насочена към разработването и комерсиализацията на синтетични ДНК продукти за лечение на рак и инфекциозни заболявания. Създадената от нея ДНК ваксина срещу COVID-19 e достигнала клинични проучвания Фаза 2 / 3. Ваксината се прилага интрадермално в две дози с интервал от 4 седмици.
- Убита ваксина на Bharat Biotech International Ltd
Създателят на ваксината е индийска биотехнологична компания – една от първите, които разработват ваксини срещу вирусите Чикунгуня и Зика, произвеждат ваксина срещу японски енцефалит. Проучванията са във Фаза 3 на клинични изпитвания. Ваксината се прилага интрамускулно в две дози, интервалът между тях е 2 седмици.
Разработваните от няколко институции в Китай убити ваксини също са във фаза 3 на клинични проучвания. Прилагат се интрамускулно в две дози, интервалът между тях е 2 или три седмици.
Част от ваксините срещу COVID-19, намиращи се в напреднала фаза на клинични проучвания
Част от ваксините срещу COVID-19, намиращи се в напреднала фаза на клинични проучвания
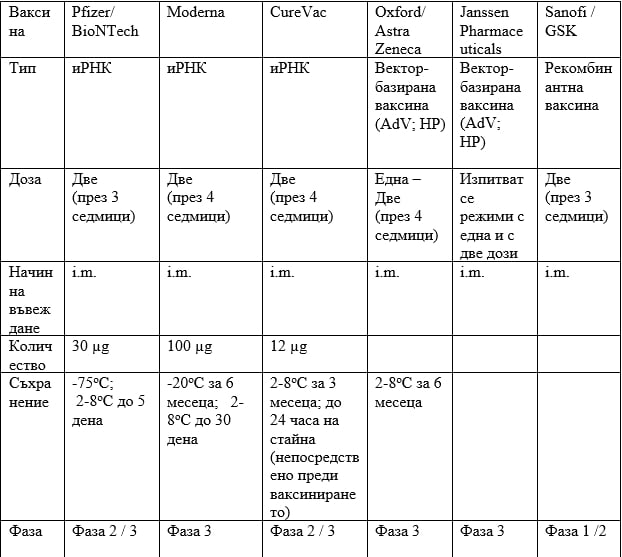
AdV = Аденовирусен вектор; НР = Нерепликативна; i.m. = Интрамускулно
Вижте част 2 на статията на професор Александрова
Снимка: Freepik
ПУБЛИКАЦИЯТА е свързана към
- Ваксините срещу COVID-19: най-често задаваните въпроси - проф. Радостина Александрова - част 2
- Назалните ваксини срещу COVID-19 помагат на имунната система да се подготви за инфекцията
- Ролята на клетките от човешки ембриони при създаването на ваксини
- Nimbus – „облачният“ вирус, който отново разбуни духовете
- Д-р Лиана Уен: Смъртта на ваксинирани срещу COVID-19 не означава, че ваксините не са ефективни
- Четири фактора, които увеличават риска от заразяване с коронавирус при ваксинирани хора
- В САЩ разрешиха бустерна доза от ваксината срещу COVID-19 на Pfizer за деца от 5 до 11 години
- Ваксинацията срещу COVID-19 – тука има, тука няма
- Гръцки медици стачкуват против задължителната ваксинация срещу COVID-19
- Идва ли Омикрон в България – все още само предположения и нито една потвърдена проба



Коментари към За вирусите, ваксините, доверието в науката и куража да продължим напред - проф. Радостина Александрова - част 1